时间:2017-07-27 08:11:43
1、填空题 (11分)在t℃时,某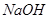 稀溶液中,
稀溶液中,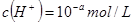 ,
,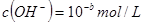 ,已知
,已知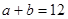 ,则:
,则:
(1)该温度下,水的离子积常数Kw=__________________。
(2)在该温度下,将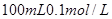 的稀硫酸与
的稀硫酸与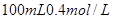 的
的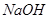 溶液混合后,溶液的pH=_________,此时该溶液中由水电离的
溶液混合后,溶液的pH=_________,此时该溶液中由水电离的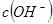 =_________。
=_________。
(3)该温度下,若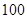 体积
体积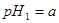 的某强酸溶液与1体积
的某强酸溶液与1体积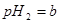 的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
的某强碱溶液混合后溶液呈中性,则混合前,该强酸的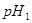 与强碱的
与强碱的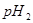 之间应满足的关系是_________。
之间应满足的关系是_________。
(4)该温度下,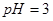 的硫酸溶液和
的硫酸溶液和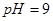 的
的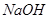 溶液等体积混合后,混合溶液的
溶液等体积混合后,混合溶液的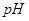 _________(填>7、=7、<7);
_________(填>7、=7、<7);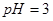 的醋酸溶液和
的醋酸溶液和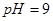 的
的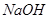 溶液等体积混合后,混合溶液的
溶液等体积混合后,混合溶液的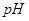 _________(填>7、=7、<7)。
_________(填>7、=7、<7)。
参考答案:(11分,第一个空1分,其它每空2分)(1)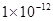
(2)11?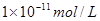
(3)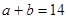 (或
(或 )
)
(4)<7;<7
本题解析:(1)Kw=c(H+)c(OH-)=10-a×10-b=10-(a+b)=10-12(2)首先酸碱中和,NaOH过量,c(OH-)==0.1mol/L,pH=-lg=11,水电离的氢氧根为10-11mol/L,(3)n(H+)=n(OH-),100×10-a=1×10-(12-b),a+b=14;(4)pH=3和pH=9的酸碱,氢离子和氢氧根离子浓度相等,中和后pH=6,醋酸和氢氧化钠中和,醋酸过量呈酸性,pH<6。
本题难度:一般
2、填空题 氯的含氧酸根有ClO-、ClO2-、ClO3-、ClO4-,其中的Cl原子都是以sp3杂化轨道与O成键。 请回答下列问题:
(1)ClO2-的空间构型是____,写出一个与之构型相同的分子的化学式:____。
(2)下列离子的空间构型与ClO3-相同的是____(填字母,下同)。
A. CO32-
B. SO42-
C. NO3-
D. SiO32-
(3)下列四种酸中,酸性最强的是____。
A. HClO
B. HClO2
C. HClO3
D.HClO4
(4)如果成酸元素R相同,羟基个数不同,则含氧酸的酸性随着分子中连接在中心原子上的非羟基氧的个数的增大而增大, 即(HO)mROn 中n值越大,酸性越强。下列酸中的酸性与HClO3相近的是________ 。
A. H3BO3
B. H3PO4
C. HNO3
D. H2SO3
参考答案:(1)V形;H2O(其他合理答案均可)
(2)B
(3)D
(4)C
本题解析:
本题难度:一般
3、选择题 下列说法正确的是( )
A.在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(OH-)减小
B.反应Hg(l)+H2SO4(aq)===HgSO4(aq)+H2(g)在常温下不能自发进行,则ΔH<0
C.工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应
D.在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4)
参考答案:AC
本题解析:A、加水稀释,加氯化铵固体抑制氨水电离,都能使溶液中的c(OH-)减小,正 确;B、该反应熵变增加,不能自发进行焓变大于零,错误;C、正确;D、两种沉淀的类型不同,一般不比较,错误。
本题难度:简单
4、选择题 将等质量的锌粒(wg)分别投入VLpH=2的盐酸和醋酸(含醋酸nmol),结果发现一种溶液中Zn有剩余,有关叙述正确的是( )
A.0.325V<w<32.5n
B.产生H2的平均反应速率盐酸大于醋酸
C.产生H2的量盐酸多于醋酸
D.与醋酸反应时锌有剩余
参考答案:A.n(HCl)=0.01Vmol,醋酸的物质的量为nmol,则消耗锌的物质的量应介于0.005Vmol~0.5nmol之间,质量为0.325V<w<32.5n,故A正确;
B.醋酸浓度较大,随着反应的进行,醋酸进一步电离出氢离子,则醋酸反应速率较大,故B错误;
C.因锌与盐酸反应过量,则醋酸生成氢气较多,故C错误;
D.与醋酸反应时锌有不足,与盐酸反应时锌过量,故D错误.
故选A.
本题解析:
本题难度:简单
5、选择题 若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是(?)
A.生成了一种强酸弱碱盐
B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应
D.一元强酸溶液和一元强碱溶液反应
参考答案:B
本题解析:若pH=3的酸溶液c(H+)=10-3mol/L; pH=11的碱溶液,c(OH-)=10-3mol/L;二者等体积混合后溶液呈酸性,可能是酸是弱酸,碱是强碱,当H+与OH-中和后,未电离的酸分子又电离产生了H+。使溶液显酸性。因此正确选项为B。
本题难度:一般