时间:2017-07-18 02:39:40
1、选择题 醋酸溶液中存在电离平衡:CH3COOH?H++CH3COO-,下列叙述不正确的是( )
A.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.CH3COOH溶液中加入少量CH3COONa?固体,CH3COOH的电离平衡逆向移动
C.0.1?mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小
D.常温下,0.01?mol/L的硫酸溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
参考答案:A.醋酸溶液中存在电荷守恒,所以得c(H+)=c(OH-)+c(CH3COO-),故A正确;
B.醋酸钠中含有醋酸根离子,向醋酸溶液中加入醋酸钠固体,抑制醋酸电离,故B正确;
C.加水稀释醋酸,促进醋酸电离,但氢离子浓度减小,温度不变,水的离子积常数不变,所以氢氧根离子浓度增大,故C错误;
D.常温下,pH=12的NaOH溶液中氢氧根离子浓度是0.01mol/L,硫酸和氢氧化钠都是强电解质,等体积等物质的量浓度的氢氧化钠和硫酸溶液中,硫酸中氢离子的物质的量大于氢氧化钠溶液中氢氧根离子的物质的量,所以混合溶液呈酸性,故D正确;
故选C.
本题解析:
本题难度:一般
2、选择题 现有常温下的四种溶液(如下表),下列有关叙述正确的是( )
| ① | ② | ③ | ④ 溶液 氨水 氢氧化钠溶液 醋酸 盐酸 PH 11 11 3 3 |
参考答案:A.氨水加水稀释时,电离程度增大,进一步电离出OH-离子,醋酸加水稀释电离程度增大,进一步电离出氢离子,则分别加水稀释10倍后四种溶液的pH大小顺序为①>②>④>③,故A正确;
B.醋酸为弱电解质,将①、④两种溶液分别稀释有PH=3到PH=5,依据[H+][OH-]=10-14,所以由水电离出氢离子的浓度均增大100倍,故B错误;
C.在氨水中加入氯化铵,抑制氨水的电离,溶液pH减小,在氢氧化钠溶液中中加入氯化铵,生成一水合氨,溶液pH减小,故C错误;
D.PH=11的氨水和PH=3的盐酸溶液,溶液中氢氧根离子和氢离子浓度相同,等体积混合,由于氨水是弱电解质存在电离平衡,混合后氢离子全部反应反应,氨水又电离出氢氧根离子,所以所得溶液中:c(OH-):c(H+)>1,故D错误;
故选A.
本题解析:
本题难度:一般
3、选择题 人体血液的正常pH约为7.35~7. 45,若在外界因素作用下突然发生改变就会引起“酸中毒” 或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:
H++HCO3-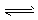 H2CO3
H2CO3 CO2+H2O,H++PO43-
CO2+H2O,H++PO43- HPO42-?, H++HPO42-
HPO42-?, H++HPO42-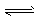 H2PO4- 故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是
H2PO4- 故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是
[? ]
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人在静脉滴注了大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH略减小
参考答案:C
本题解析:
本题难度:一般
4、选择题 25°C时,弱酸的电离平衡常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1:4.3×10-7 K2:5.6×10-11 |
参考答案:D
本题解析:A项,酸越弱,其对应的盐的水解程度越大,溶液的pH越大,结合表格的数据可知pH大小关系为pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故不正确;B项,若a=b,则两者恰好完全反应生成NaCN溶液,因CN-水解也能使溶液中的c(Na+)>c(CN-),故不正确。根据冰醋酸加水导电性曲线,C项错误,D项符合电荷守恒,正确。
本题难度:一般
5、选择题 用水稀释0.1 mol·L-1氨水时,溶液中随着水量的增加而增大的是?
[? ]
A.c(OH-)/c(NH3·H2O)
B.c(NH3·H2O)/c(OH-)?
C.c(H+)和c(OH-)的乘积?
D.H+的物质的量浓度?
参考答案:AD
本题解析:
本题难度:一般