时间:2017-07-18 02:07:20
1、填空题 A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大。其中,元素M的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍,E的简单离子在同周期元素的简单离子中半径最小,D、G同主族;B与D形成的化合物有多种,其中一种是红棕色气体。
(1)M的基态原子价层电子排布式为_____,元素B、D、G的第一电离能由大到时小的顺序是_____ (用元素符号表示)。
(2)用价层电子对互斥理论预测,GD32-的立体构型是_____ (用文字表述)
(3)M与D形成的一种橙红色晶体晶胞结构如图所示,其化学式为_____ (用元素符号表示)。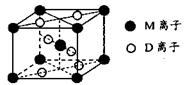
(4)已知化合物EB结构与单晶硅相似,该物质可由E 的氯化物与NaB3在高温下反应制得,且生成单质B2,该反应化学方程式为_____,若有8.4gB2生成,则转移电子数为_____。
参考答案:(14分)
(1)3d24s2(2分)? N>O>S(2分)
(2)三角锥形(2分)?
(3)TiO2(3分)
(4)AlCl3+3NaN3=?3NaCl+AlN+4N2↑(3分)? 1.204×1023或0.2NA(2分)
本题解析:A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大。其中元素M的基态3d轨道上有2个电子,价层电子排布式3d24s2,为钪元素;A的基态原子L层电子数是K层电子数的2倍,元素A为碳元素,E的简单离子在同周期元素的简单离子中半径最小,元素E为铝;B与D形成的化合物有多种,其中一种是红棕色气体,很显然元素B为氮元素,D为氧元素。D、G同主族,G为硫元素;
本题难度:一般
2、选择题 纳米材料表面微粒的比例极大,这是它有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如图所示),则这种纳米颗粒的表面微粒数与总微粒数的比值为 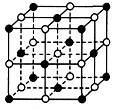
[? ]
A.7:8
B.13:14
C.25:26
D.26:27
参考答案:D
本题解析:
本题难度:一般
3、选择题 最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该新型超导晶体的一个晶胞如下图所示,则该晶体的化学式为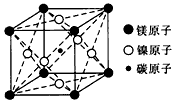
[? ]
A. Mg2CNi3
B. MgC2Ni
C. MgCNi2
D. MgCNi3
参考答案:D
本题解析:
本题难度:一般
4、填空题 雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得。
(1)元素第一电离能:Al________Mg(选填:“>”、“<”、“=”)
(2)雷尼镍催化的一实例为:
化合物b中进行sp3杂化的原子有:______________。
(3)一种铝镍合金的结构如下图,与其结构相似的化合物是:_________
(选填序号:a.氯化钠 b.氯化铯 c.石英 d.金刚石)。 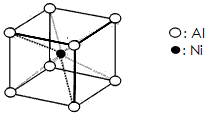
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
①Ni2+在基态时,核外电子排布式为:______________。
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4)。 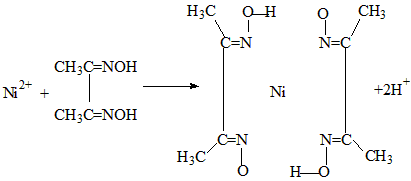
参考答案:(1)<
(2)C、N、O
(3)b
(4)①1s22s22p63s23p63d8或[Ar]3d8②
本题解析:
本题难度:一般
5、选择题 下列叙述正确的是( )?
A.离子晶体中一定含有活泼金属元素的离子?
B.原子晶体都是化合物?
C.固态不导电、水溶液能导电,这一性质能说明某晶体一定是离子晶体?
D.离子晶体一般具有较高的熔点?
参考答案:D?
本题解析:某些离子晶体可能只含有非金属元素的原子,如NH4Cl、CH3COONH4等,因此选项A不正确。原子晶体可以是化合物,如水晶,也可以是单质,如金刚石,所以B选项不正确。离子晶体和某些分子晶体(如冰醋酸)都具有固态不导电、水溶液能导电的性质,因此这一性质不能说明某晶体一定是离子晶体,选项C不正确。?
一般来说,固态不导电,溶于水或熔融状态均能导电这一性质能较充分说明某晶体是离子晶体,因为熔融状态下分子晶体不导电。
本题难度:一般