时间:2017-07-18 02:07:20
1、选择题 下列物质属于分子晶体的是(?)?
A.熔点是1070℃,易溶于水,水溶液能导电
B.熔点是10.31℃,液态不导电,水溶液能导电
C.能溶于水,熔点812.8℃,沸点是1446℃
D.熔点是97.80℃,质软、导电,密度是0.97g/cm3
参考答案:B
本题解析:分子晶体的熔沸点比较低,有些能够在水中溶解,有些不能在水中溶解。固体或液态时本身不能导电,水溶液有的导电,有的不导电。综上所述,正确的选项为B。
本题难度:一般
2、选择题 关于CO2说法正确的是
A.碳原子采取sp杂化
B.CO2是正四面体型结构
C.干冰是原子晶体
D.CO2为极性分子
参考答案:A
本题解析:
正确答案:A,碳形成两个δ键,两个∏键;B为直线型;C为分子晶体;D为非极性分子
本题难度:一般
3、填空题 图为甲、乙、丙三种离子晶体的晶胞(晶体中最小的重复单元)结构,在甲晶体中X处于晶胞中心,乙中A处于晶胞中心。请推知:甲晶体中X与Y的个数比是_____。乙晶体中A与B的个数比是______。丙品体的一个晶体中有个C离子,有_______个D离子。 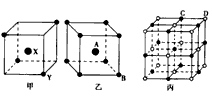
参考答案:2:1;1:1;4
本题解析:
本题难度:一般
4、选择题 下列分子中,键角最大的是
[? ]
A. H2S
B. H2O
C. CCl4
D. NH3
参考答案:C
本题解析:
本题难度:简单
5、选择题 纳米材料表面微粒的比例极大,这是它有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如图所示),则这种纳米颗粒的表面微粒数与总微粒数的比值为 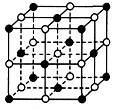
[? ]
A.7:8
B.13:14
C.25:26
D.26:27
参考答案:D
本题解析:
本题难度:一般