时间:2017-07-18 01:50:17
1、选择题 观察下列模型并结合有关信息,判断有关说法正确的是
| ? | 硼晶体的结构单元 | SF6分子 | S8分子 | NaCl |
| 结构模型示意图 | 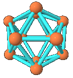 | 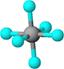 | 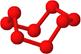 | 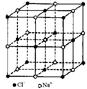 |
| 备注 | 熔点1873K | / | 易溶于CS2 | / |
参考答案:B
本题解析:A.单质硼属原子晶体,其结构单元B12中含有30个B-B键,含20个正三角形。错误。B.SF6是由极性键构成的非极性分子。正确。C.固态硫S8属于分子晶体。错误。D.NaCl是离子晶体。在熔化和溶于水均能电离产生自由移动的离子,且破坏的都是离子键,在NaCl晶胞中每个Na+周围最近且等距离的Na+有6个,分别位于该原子的上、下、左、右、前、后六个方向。正确。
本题难度:一般
2、填空题 写出下列反应的热化学方程式:
(1)10g乙烷(C2H6)气体完全燃烧生成液态水放出热量520kJ.
(2)10gCaCO3高温分解吸收热量17.56kJ.
& #160;
参考答案:(4分,每小题2分)
(1)2C2H6(g) + 7O2(g) = 4CO2(g) + 6H20(l); △H=-3120kJ/mol;
(2)CaCO3(s) = CaO(s) + CO2(g); △H=+175.6kJ/mol。
本题解析:(1)10g乙烷(C2H6)气体完全燃烧生成液态水放出热量520kJ,那么2mol乙烷(C2H6)气体完全燃烧生成液态水放出热量3120kJ,故乙烷燃烧的化学方程式为2C2H6(g) + 7O2(g) = 4CO2(g) + 6H20(l) △H=-3120kJ/mol。
(2)10gCaCO3高温分解吸收热量17.56kJ,那么1molCaCO3高温分解吸收热量175.6kJ,故CaCO3高温分解的热化学方程式为CaCO3(s) = CaO(s) + CO2(g); △H=+175.6kJ/mol。
考点:热化学方程式
点评:本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比。
本题难度:一般
3、选择题 下列叙述不正确的是
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.氢氧燃料电池是一种将化学能转化为电能的装置
C.可用浸有酸性高锰酸钾溶液的滤纸来检验二氧化硫气体的漂白性
D.塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解
参考答案:C
本题解析:纯银器表面不能构成原电池,因为无活泼性不同的两个电极,因此只可能在空气中发生化学腐蚀而慢慢变暗,故A选项正确;氢氧燃料电池属于化学电源,应用原电池原理,因此能将化学能转化为电能,故B选项正确;酸性高锰酸钾是有颜色的无机物,具有强氧化性,二氧化硫使其紫红色褪色,只能证明二氧化硫的还原性,使有颜色的有机物褪色,发生了非氧化还原反应,才能证明二氧化硫的漂白性,故C选项错误;塑料是合成高分子材料,难以降解,导致白色污染,故D选项正确。
本题难度:简单
4、填空题 (14分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)一氧化碳在高温下与水蒸气反应的方程式为:CO+H2O=CO2+H2。已知部分物质燃烧的热化学方程式如下: 2H2 (g) + O2(g) = 2H2O(l);△H=-571.6kJ·mol-1
2CO (g) + O2(g) = 2CO2 (g) ;△H=-566kJ·mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CO和水蒸气在高温催化剂下反应的热化学方程式 。
(3)在25℃下,向浓度为0.1 mol·L-1的AlCl3溶液中逐滴加入氨水,生成该沉淀的离子方程式为______________________________。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式 。
(5)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=1的H2SO4溶液VaL与pH=11的NaOH溶液VbL混合,若所得混合液为中性,则
Va
参考答案:
本题解析:
本题难度:一般
5、选择题 常温下,分别在溶液中发生如下反应:(1)16H++10Z-+2XO4-═2X2++5Z2↑+8H2O,(2)2A?2++B2═2A3++2B-,(3)2B-+Z2═B2+2Z-.由此判断下列说法错误的是
A.反应Z2+2A?2+═2A3++2Z-能发生
B.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+
C.还原性由强到弱的顺序是?A?2+、B-、Z-、X2+
D.Z元素在(1)、(3)反应中均被还原
参考答案:D
本题解析:分析:氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则16H++10Z-+2XO4-═2X2++5Z2↑+8H2O中氧化性为XO4->Z2,2A2++B2═2A3++2B-中氧化性为B2>A3+,2B-+Z2═B2+2Z-.中氧化性为Z2>B2,以此来解答.
解答:氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则16H++10Z-+2XO4-═2X2++5Z2↑+8H2O中氧化性为XO4->Z2,2A2++B2═2A3++2B-中氧化性为B2>A3+,2B-+Z2═B2+2Z-.中氧化性为Z2>B2,
A.由上述分析可知,氧化性Z2>A3+,则反应Z2+2A?2+═2A3++2Z-能发生,故A正确;
B.由上述分析可知,氧化性由强到弱的顺序是XO4-、Z2、B2、A3+,故B正确;
C.氧化性越强,对应离子的还原性越弱,则还原性由强到弱的顺序是?A?2+、B-、Z-、X2+,故C正确;
D.Z元素在(1)中化合价升高,被氧化,而在(3)中元素的化合价降低,被还原,故D错误;
故选D.
点评:本题考查氧化还原反应,侧重氧化性、还原性的比较的考查,明确反应中元素的化合价变化及氧化性的比较方法即可解答,题目难度不大.
本题难度:简单