时间:2017-07-18 01:49:55
1、选择题 下列离子方程式中,属于水解反应的是
[? ]
 HCOO-+ H3O+
HCOO-+ H3O+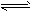 HCO3-+ H+
HCO3-+ H+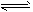 HCO3-+OH-
HCO3-+OH-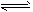 S2-+H3O+
S2-+H3O+ 参考答案:C
本题解析:
本题难度:简单
2、填空题 回答下列有关Na2S溶液的问题。
(1)Na2S溶液盛装在带橡胶塞的试剂瓶中,仔细闻有臭鸡蛋气味,请用离子方程式解释:
, 。
(2)将Na2S溶液加入AlCl3溶液中,有白色沉淀和臭鸡蛋气味的气体生成,发生的离子反应为:
。
(3)将Na2S溶液加入AgCl的浊液中,生成的黑色沉淀是 (写化学式)。
参考答案:(1)S 2-+ H2O HS- +OH-, HS-+ H2O
HS- +OH-, HS-+ H2O H2S +OH-
H2S +OH-
(2)2Al 3+ + 3S 2-+6 H2O = 3H2S↑+ 2Al(OH)3↓
(3)Ag2S
本题解析:(1)多元弱酸根离子要分步水解,以第一步为主
(2)Al 3+与S 2-水解生成Al(OH)3沉淀
(3)S 2-与 结合成Ag2S
结合成Ag2S
考点:考查水解
本题难度:一般
3、选择题 能使0.1mol/LCH3COONa溶液的pH值增大的方法是
A.加水
B.加盐酸
C.加热
D.加氯化铵晶体
参考答案:C
本题解析:
CH3COONa溶液中CH3COO-可以发生水解反应:CH3COO-+H2O CH3COOH+OH-,
CH3COOH+OH-,
A.加水稀释,虽然促进了水解,但c(OH-)是减小的,故pH值减小,故A不合题意;
B.加盐酸,消耗OH-,虽然促进了水解,但c(OH-)是减小的,故pH值减小,故B不合题意;
C.解热促进水解平衡右移,使c(OH-)增大,故pH值增大,故C符合题意;
D.加氯化铵晶体,NH4+会与OH-结合,使c(OH-)减小,故pH值减小,故D不合题意。
考点:考查盐类的水解的影响因素
点评:本题考查了盐类的水解的影响因素,难度不大。解题时应从平衡移动的角度来分析盐类水解的影响因素对平衡的移动。
本题难度:一般
4、选择题 常温下,下列有关物质的量浓度关系正确的是
A.等物质的量浓度的溶液中,水电离出的c(H+):HCl>CH3COOH
B.pH相同的溶液中:c(Na2CO3)<c(NaHCO3)
C.在Na2SO3溶液中:c(Na+) = 2c(SO32— ) + c(HSO3— ) + c(OH— )
D.0.1mol·L—1NaHS溶液中:c(Na+) = c(HS-)
参考答案:B
本题解析:A.盐酸是强酸,完全电离,醋酸是弱酸,部分电离,当二者物质的量浓度相等时,电离产生的c(H+)盐酸大,酸电离产生的c(H+)越大,对水电离平衡的影响也就越大,在水的溶液中,水电离出的c(H+)就越小,所以水电离出的c(H+):HCl<CH3COOH,错误;B.Na2CO3和NaHCO3都是强碱弱酸盐,水解是溶液显碱性,由于等浓度时水解程度:Na2CO3>NaHCO3,所以当溶液pH相同的溶液中:c(Na2CO3)<c(NaHCO3),正确; C.在Na2SO3溶液中,根据物料守恒可得:c(Na+) = 2c(SO32— ) + 2c(HSO3— ) + 2c(H2SO3) ,错误;D.在0.1mol·L—1NaHS溶液中,根据物料守恒可得:c(Na+) = c(HS-)+ c(S2-)+ c(H2S),错误。
考点:考查电离平衡、盐的水解平衡在微粒浓度大小比较中的应用的知识。
本题难度:一般
5、填空题 (8分)⑴ 现有0.1mol·l-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作 。
⑵ 欲使0.1mol-1Na2CO3溶液中c(Na+)=2 c(CO32-),应采取的措施是 ( )
A.加少量盐酸 B.加适量的KOH C.加适量的水 D.加适量的NaOH
⑶ 为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是( )
A.甲同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。
B.乙同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。
C.丙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。
D.丁同学:在氨水加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的。
⑷ 为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案。
参考答案:(8分)(每空2分)
⑴ 把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较确定溶液的pH
⑵ B
⑶ A
⑷ 向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去,说明纯碱溶液的碱性是由CO32-引起的
本题解析:(2)Na2CO3溶液中由于CO32-水解,CO32-+H2O HCO3-+OH-,导致c(Na+)>2 c(CO32-)。故可以加KOH,抑制其水解,符合题意。但加盐酸将发生:CO32-+H+=HCO3-,破坏CO32-,不符合题意;同样,加水稀释会促进其水解,不符合题意;加适量的NaOH,虽然能抑制其水解,但同时增加了Na+,不会满足题意
HCO3-+OH-,导致c(Na+)>2 c(CO32-)。故可以加KOH,抑制其水解,符合题意。但加盐酸将发生:CO32-+H+=HCO3-,破坏CO32-,不符合题意;同样,加水稀释会促进其水解,不符合题意;加适量的NaOH,虽然能抑制其水解,但同时增加了Na+,不会满足题意
(3)B:本质是发生了中和反应,有中和热的放出,导致温度升高
C:硝酸铵晶体溶于水,其溶解过程是吸热过程,导致水温降低
D:氨水加入氯化铵固体,是由于氨根离子的增多,抑制了氨水的电离,导致碱性减弱
本题难度:困难