时间:2017-07-18 01:49:55
1、填空题 已知:RCH2COOH
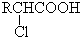
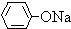
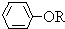
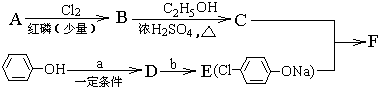
参考答案:(1)设A的分子式为CnH2nO2,则有:
CnH2nO2+NaHCO3→CnH2n-1O2Na+CO2↑+H2O
(14n+32)22.4L
8.8?2.24L?
则14n+328.8=22.42.24,
解得n=4,即A的分子式为C4H8O2,故答案为:C4H8O2;
(2)A分子式为C4H8O2,所有甲酸酯的结构为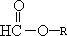
,R为丙基,有两种,可为-CH2CH2CH3或-CH(CH3)CH3,所以同分异构体有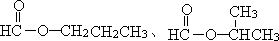
两种,
故答案为: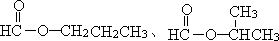
;
(3)根据B是氯代羧酸,且核磁共振氢谱有两个峰,可推出B的结构简式为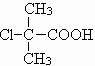
,进而确定A为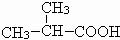
,C为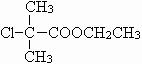
,F为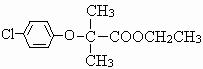
,B与C发生酯化反应,反应的化学方程式为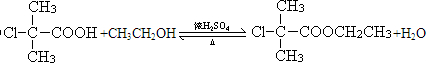
,
故答案为:
;
(4)C+E→F的反应可看成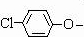
取代-Cl的反应,故答案为:取代反应;
(5)由题中推断可知A为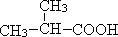
,F为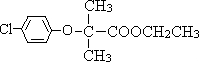
,
故答案为: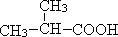
;
;
(6)由E的结构简式和D的苯环上有两种氢,可以确定D为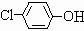
,其中含有的官能团有羟基和氯原子;是苯酚和Cl2反应的产物,与NaOH或Na2CO3溶液反应生成E.
故答案为:羟基、氯原子; Cl2;NaOH溶液;
(7)C在NaOH乙醇溶液中加热发生消去反应,生成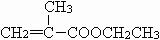
(G),故答案为:消去反应;
(8)G加聚生成H,反应的化学方程式为
,
故答案为:
.
本题解析:
本题难度:一般
2、填空题 (10分)常温下 ,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液,
,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液,
(1)该溶液中存在的三个平衡体系是________________________________________、______________________________、___________________________。(用方程式表 示)
示)
(2)溶液中共有 种不同的粒子。
(3)这些粒子中浓度为0.01mol/L的是 ,浓度为0.002mol/L的是 。
(4)物质的量之和为0.01mol的两种粒子是 和 ___。
(5) 和 两种粒子数量之和比OH-多0.008mol
参考答案:(10分)
(1)NH3·H2O NH4++OH-;NH4++H2O
NH4++OH-;NH4++H2O NH3·H2O+H+;H2O
NH3·H2O+H+;H2O H++OH-(各1分)(2)七(1分)(3)Cl-;Na+(2分)(4)NH4+、NH3·H2O (2分)(5)NH4+;H+(2分)
H++OH-(各1分)(2)七(1分)(3)Cl-;Na+(2分)(4)NH4+、NH3·H2O (2分)(5)NH4+;H+(2分)
本题解析:略
本题难度:一般
3、选择题 在10ml 0.1mol/L NaOH溶液中加入等体积、等浓度的CH3COOH溶液,反应后溶液中各粒子的浓度关系错误的是
A.C(Na+)>C(CH3COO-)>C(H+)>C(OH-)
B.C(Na+)>C(CH3COO-)>C(OH-)>C(H+)
C.C(Na+)= C(CH3COO-)+C(CH3COOH)
D.C(Na+)+ C(H+)= C(CH3COO-)+C(OH-)
参考答案:A
本题解析:略
本题难度:一般
4、选择题 NH4Cl溶液中的离子浓度大小关系正确的是
A.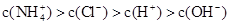
B.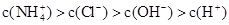
C.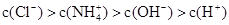
D.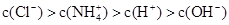
参考答案:D
本题解析:根据电荷守恒可知c(NH4+)+c(H+)=c(OH-)+c(Cl-)。由于铵根离子水解消耗水电离产生的OH-,所以c(H+)>c(OH-);c(Cl-) > c(NH4+),但是盐的水解程度是微弱的,盐的电离远大于弱电解质水的电离,因此c(NH4+)> c(H+)。故离子浓度关系是c(Cl-) > c(NH4+) >c(H+)>c(OH-)。选项是D。
考点:考查盐的水解、溶液中离子浓度的大小比较的知识。
本题难度:一般
5、选择题 在配置Fe2(SO4)3溶液时,为了防止水解,常常往溶液中加入少量的( )
A.NaOH
B.H2SO4
C.KCl
D.CH3COOH
参考答案:B
本题解析:硫酸铁水解生成氢氧化铁和硫酸,为抑制水解,加少量硫酸。
考点:盐类水解的应用
点评:配制氯化铁溶液时,为防止水解,可将氯化铁溶液溶于盐酸,再加水稀释到所需浓度。
本题难度:一般