时间:2017-07-18 01:49:55
1、选择题 0.02mol·L—1的HCN溶液与0.02mol·L—1的NaCN溶液等体积混合,已知混合溶液中C(CN-)<C(Na+),则下列关系中,正确的是:
A.C(Na+)>C(CN-)>C( H+)>C(OH-)
B.C(HCN)+C (CN-)=0.04mol·L-1
C.C(CN-)>C(HCN)
D.C(Na+)+C(H+)= C(CN-)+C(OH-)
参考答案:D
本题解析:设以100L等体积混合,即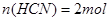 ;
;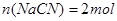 溶合后,根据电荷守恒得
溶合后,根据电荷守恒得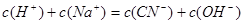 ,因C(CN-)<C(Na+),得
,因C(CN-)<C(Na+),得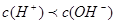 ,即混合溶液显碱性,以CN—的水解为主;所以
,即混合溶液显碱性,以CN—的水解为主;所以
A错,正确为C(Na+)>C(CN-)>C(OH-)>C( H+);B错,C(HCN)+C (CN-)=0.02mol·L-1;C错,正确关系为C(HCN)>C(CN-);D正确,电荷守恒;
本题难度:困难
2、填空题 (10分)常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。
回答下列问题:
(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是_________________。
(2)常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”),用离子方程式表示其原因: 。
(3)若此时溶液的pH=10,则c(MOH)+c(OH-)=________mol·L-1。
参考答案:(1)强酸 0.01 mol·L-1 HA溶液的pH=2,说明完全电离(2) < M+ + H2O MOH + H+ 0.005
MOH + H+ 0.005
本题解析:(1)分析图像中的pH变化曲线,起始时溶液的pH值为2,说明HA酸完全电离则为一元强酸。(2)由于是向100mL0.01mol·L-1 HA溶液中逐滴加入0.02mol·L-1MOH溶液,可知当加入50mL时,两者恰好完全反应,此时溶液的pH值小于7,说明碱是一元弱碱,MA就是强酸弱碱盐,水解溶液显酸性,M+水解的离子方程式为:M+ + H2O MOH + H+(3)若K的对应pH=10,根据物料守恒,则溶液中c(MOH)+c(M+)=10-2mol·L-1,HA为一元强酸,故c(A-)=0.005mol·L-1,根据溶液中的电荷守恒,可得出:c(A-)+ c(OH-)=" c" (H+)+ c(M+),将上述两式代入可得:c (MOH)+ c(OH-)-c (H+)=0.005mol·L-1,c (H+)忽略不计,故:c (MOH)+ c(OH-)=0.005mol·L-1
MOH + H+(3)若K的对应pH=10,根据物料守恒,则溶液中c(MOH)+c(M+)=10-2mol·L-1,HA为一元强酸,故c(A-)=0.005mol·L-1,根据溶液中的电荷守恒,可得出:c(A-)+ c(OH-)=" c" (H+)+ c(M+),将上述两式代入可得:c (MOH)+ c(OH-)-c (H+)=0.005mol·L-1,c (H+)忽略不计,故:c (MOH)+ c(OH-)=0.005mol·L-1
考点:结合图像考查了水溶液的pH值、电离水解等知识。
本题难度:一般
3、填空题 (11分)(1)常温下,0.10 mol·L-1 NH4Cl溶液pH______7(填“>”、“=”或“<”)。
(2)相同物质的量浓度的Na2CO3溶液与NaHCO3溶液,pH大小:Na2CO3________NaHCO3(填“>”、“=”或“<”)。
(3)在配制FeCl3溶液时,应加入__________,目的是_____________。
(4)Na2S溶液中滴入酚酞溶液显______色,原因是__________________。(用离子方程式表示),
(5)将氯化铝溶液蒸干并灼烧得到的固体物质是 ;(填化学式,下同)将硫酸铝溶液蒸干得到的固体物质是 。
参考答案:(1)<; (2)>;(3) 盐酸,抑制FeCl3水解;(4)红,S2-+H2O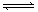 HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O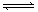 H2S+OH-;(5)Al2O3,Al2(SO4)3。
H2S+OH-;(5)Al2O3,Al2(SO4)3。
本题解析:(1) NH4+水解生成NH3?H2O和H+,溶液呈酸性,则pH<7;(2)两溶液水解呈碱性,Na2CO3以第一步水解为主,Na2CO3的水解程度大于NaHCO3,所以Na2CO3的PH大于NaHCO3;(3) FeCl3水解产生Fe(OH)3和HCl,在配制FeCl3溶液时,应加入盐酸,抑制FeCl3水解;(4)硫化钠水解,S2-+H2O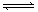 HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O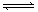 H2S+OH-,溶液显碱性,滴入酚酞试液,溶液呈红色;(5)加热促进氯化铝水解,且氯化氢有挥发性,导致蒸干时得到氢氧化铝固体,再将固体灼烧,氢氧化铝分解生成氧化铝和水,则最后得到的固体是氧化铝;加热促进硫酸铝水解,但硫酸没有挥发性,所以蒸干时得到的固体是硫酸铝。
H2S+OH-,溶液显碱性,滴入酚酞试液,溶液呈红色;(5)加热促进氯化铝水解,且氯化氢有挥发性,导致蒸干时得到氢氧化铝固体,再将固体灼烧,氢氧化铝分解生成氧化铝和水,则最后得到的固体是氧化铝;加热促进硫酸铝水解,但硫酸没有挥发性,所以蒸干时得到的固体是硫酸铝。
考点:考查盐类水解及溶液中离子浓度大小关系比较。
本题难度:一般
4、填空题 工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2。无隔膜法电解冷的食盐水相应的离子方程式为 。
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。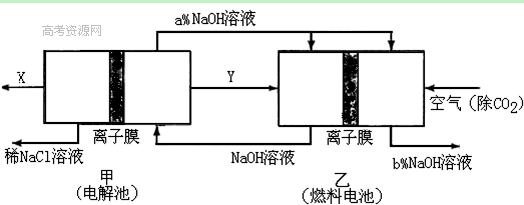
①经精制的饱和NaCl溶液应从图中电解池的 (填写“左” 或“右”)池注入。
②图中X是____ __(填化学式);乙中右室的电极反应式为: _ ,图示中氢氧化钠溶液质量分数a%与b%的关系是 (填字母)。
A. a%=b% B. a%
参考答案:
本题解析:
本题难度:困难
5、选择题 对滴有酚酞试液的下列溶液,操作后颜色变深的是 ( )
A.AlCl3溶液中再溶入AlCl3
B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体
D.醋酸溶液加热
参考答案:B
本题解析:A项,氯化铝溶液中加入氯化铝,铝离子的水解平衡向右移动,溶液酸性增加,溶液颜色不会变深;B项,醋酸钠水解使溶液显碱性,加热可促进水解,使溶液碱性增强,溶液颜色变深;C项,氨水中加入少量氯化铵固体,氨水的电离平衡左移,使氨水的碱性减弱;D项,醋酸溶液加热可促进醋酸的电离,使溶液酸性增强。
本题难度:一般