时间:2017-07-18 00:57:04
1、选择题 把a、b、c、d四块金属浸入稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时a溶解;c、d相连时c为负极;a、c相连时,c极上产生大量气泡;b、d相连时,b为正极,则四种金属活动性顺序由强到弱为(? )?
A.a>b>c>d
B.a>c>d>b
C.c>a>b>d
D.b>d>c>a
参考答案:B
本题解析:原电池中,活泼金属作负极,失去电子,溶解。a、b相连时a溶解,a>b;c、d相连时c为负极,c>d;a、c相连时,c极上产生大量气泡,c作正极,a>c;b、d相连时,b为正极,d>b.
所以综上:a>c>d>b
点评:本题解题关键在于根据实验现象来判断哪一个是正极,哪一个是负极,而原电池中负极的金属活动性大于正极。
本题难度:简单
2、选择题 最早使用的化学电源(chemical power source))是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如下图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO2+2H2O+2e-==2MnO(OH)+2OH-
F极:Zn+2NH4Cl==Zn(NH3)2Cl2+2H++2e-
总反应式:2MnO2+Zn+2NH4Cl === 2MnO(OH)+Zn(NH3)2Cl2
下列说法正确的是 
[? ]
A.E极是电池的正极,发生的是氧化反应
B.F极是电池的负极,发生的是氧化反应
C.从结构上分析,锌锰电池应属于可充电电池
D.锌锰电池内部发生的氧化还原反应是可逆的
参考答案:B
本题解析:
本题难度:一般
3、选择题 某种甲醇(CH3OH)燃料电池示意图如下,其中电解质是稀酸溶液。下列叙述错误的是
A.电池反应中甲醇被氧化
B.质子交换膜的作用相当于盐桥
C.产生电能时,负极附近溶液的pH暂时升高
D.负极反应式是:CH3OH-6e-+H2O=CO2+6H+
参考答案:C
本题解析:原电池中负极失去电子,电极反应式为CH3OH-6e-+H2O=CO2+6H+,因此负极附近溶液的pH降低,C不正确,其余都是正确的,答案选C。
本题难度:一般
4、填空题 研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示) 。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:
负极 ,正极 。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。(填序号)
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3、NO的体积比保持不变
D.每消耗 1 mol SO2,同时生成1 mol NO
当测得上述平衡体系中NO2与SO2体积比为1:6时,则该反应平衡常数K值为 ;
(4)工业常用Na2CO3饱和溶液回收NO、NO2气体:
NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2
若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为 。
参考答案:(1)CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(2)负极:2CH3OH-12e-+2H2O 2CO2+12H+ 正极:3O2+12e-+12H+ 6H2O
(3) B 2.67(或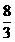 ) (4)1∶7
) (4)1∶7
本题解析:(1)因为化学反应的过程就是原子重新组合的过程,由于“绿色化学”就是反应物的原子完全转化为目标生成物,所以使用CO、H2来制取CH3OH 。反应的方程式为:CO(g)+2H2(g) CH3OH(g)。(2)左边通入甲醇的电极为负极,电极反应为:2CH3OH-12e-+2H2O=2CO2+12H+;右边通入O2的电极为正极,由于是酸性介质,发生的电极反应为:3O2+12e-+12H+=6H2O。(3)NO2和SO2反应生成SO3(g)和NO的方程式为:NO2+SO2
CH3OH(g)。(2)左边通入甲醇的电极为负极,电极反应为:2CH3OH-12e-+2H2O=2CO2+12H+;右边通入O2的电极为正极,由于是酸性介质,发生的电极反应为:3O2+12e-+12H+=6H2O。(3)NO2和SO2反应生成SO3(g)和NO的方程式为:NO2+SO2 SO3(g)+NO.A.该反应是反应前后气体体积相等的可逆反应,所以无论反应是否达到平衡,反应的压强都不会发生变化。B.由于容器的容积不变,若反应达到平衡,任何物质的物质的量不变,NO2是有色的物质,其浓度不变,所以混合气体颜色保持不变。因此该反应达到平衡。正确。C.发生反应NO2+SO2
SO3(g)+NO.A.该反应是反应前后气体体积相等的可逆反应,所以无论反应是否达到平衡,反应的压强都不会发生变化。B.由于容器的容积不变,若反应达到平衡,任何物质的物质的量不变,NO2是有色的物质,其浓度不变,所以混合气体颜色保持不变。因此该反应达到平衡。正确。C.发生反应NO2+SO2 SO3(g)+NO ,每产生SO31mol,必然同时产生NO1mol。因此无论反应是否达到平衡,SO3、NO的体积比始终保持不变。故不能作为反应达到平衡的标志。错误。D.SO2是反应物,NO为生成物,方程式中二者的物质的量的比为1:1,所以每消耗 1 mol SO2,同时生成1 mol NO ,与反应是否达到平衡无关,因此不能作为反应达到平衡的标志。错误。假设反应开始时,n(NO2)="amol;" n(SO2)=2amol.。在反应过程中?n(NO2)="xmol" ,则?n(SO2)=xmol,则达到平衡是反应NO2+SO2
SO3(g)+NO ,每产生SO31mol,必然同时产生NO1mol。因此无论反应是否达到平衡,SO3、NO的体积比始终保持不变。故不能作为反应达到平衡的标志。错误。D.SO2是反应物,NO为生成物,方程式中二者的物质的量的比为1:1,所以每消耗 1 mol SO2,同时生成1 mol NO ,与反应是否达到平衡无关,因此不能作为反应达到平衡的标志。错误。假设反应开始时,n(NO2)="amol;" n(SO2)=2amol.。在反应过程中?n(NO2)="xmol" ,则?n(SO2)=xmol,则达到平衡是反应NO2+SO2 SO3(g)+NO平衡体系中n(NO2)=(a-x)mol;n(SO2)=(2a-x)mol;n(SO3)=xmol;n(NO)=xmol。由于平衡时NO2与SO2体积比为1:6,所以(a-x):(2a-x)=1:6.解得
SO3(g)+NO平衡体系中n(NO2)=(a-x)mol;n(SO2)=(2a-x)mol;n(SO3)=xmol;n(NO)=xmol。由于平衡时NO2与SO2体积比为1:6,所以(a-x):(2a-x)=1:6.解得 .所以在该温度下该反应平衡常数
.所以在该温度下该反应平衡常数 。(4)由方程式可以看出:每产生1mol的CO2,消耗混合气体2mol。现在产生2.24L标志状况下的CO2,即产生0.1 mol CO2,所以消耗气体0.1mol..则混合气体的摩尔质量为44g/mol.假设NO为xmol, NO2为(1-x)mol.30x+46(1-x)=44.则x:(1-x)=1:7.
。(4)由方程式可以看出:每产生1mol的CO2,消耗混合气体2mol。现在产生2.24L标志状况下的CO2,即产生0.1 mol CO2,所以消耗气体0.1mol..则混合气体的摩尔质量为44g/mol.假设NO为xmol, NO2为(1-x)mol.30x+46(1-x)=44.则x:(1-x)=1:7.
考点:考查化学反应的经济性、原电池中电极反应式的书写、化学平衡状态的判断、平衡常数的计算、气体混合物中物质的混合比例的计算的知识。
本题难度:困难
5、选择题 上海自主研发了一种氢燃料汽车。它是以30%KOH溶液为电解质的氢氧燃料电池,下列有关说法中,不正确的是(? )。
A.正极反应:O2 + 2H2O + 4e- ="==" 4OH-
B.当正极消耗22.4 L H2时,负极11.2 L O2消耗(相同条件)
C.发生氧化反应的是负极
D.氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池
参考答案:B
本题解析:A、氢氧燃料电池的正极是氧气发生还原反应,此电池的电解质是氢氧化钾,所以O2 + 2H2O + 4e- ="==" 4OH-,正确;B、正极消耗氧气,负极消耗氢气,错误; C、氢氧燃料电池发生氧化反应的是负极,正确;D、氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池,正确,答案选B。
本题难度:一般