时间:2017-07-18 00:57:04
1、选择题 根据下图可判断下列离子方程式中错误的是(?)
A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)=2Ag(s)+Cd2+(aq)
D.2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq)
参考答案:A
本题解析:根据原电池中正负极可知,氧化性强弱顺序是Ag+>CO2+>Cd2+,所以Cd2+不可能氧化单质银,A是不可能的,其余都是正确的,答案选A。
本题难度:一般
2、选择题 在图所示的原电池中,负极发生的反应是( )
A.Cu2++2e-═Cu
B.Cu-2e-═Cu2+
C.2H++2e-═H2↑
D.Zn-2e-═Zn2+
参考答案:图为铜锌原电池,Zn比Cu活泼,应为原电池的负极,负极反应为Zn-2e-═Zn2+,
正极反应为2H++2e-═H2↑,
故选D.
本题解析:
本题难度:一般
3、选择题 有A、B、C、D四种金属,常温下只有C能和水反应生成氢气,B与A用导线相连插入稀硫酸形成原电池时,A电极附近有气泡产生,A能从D的硝酸盐溶液中能把D置换出来,则四种金属失电子能力从强到弱的顺序是( )
A.C>B>A>D
B.C>D>A>B
C.C>A>B>D
D.D>C>B>A
参考答案:由金属活动性顺序表的应用可知,A、B、C、D四种金属,只有C可与稀硫酸反应放出H2,说明了C的活动性大于A、B、D;
又由题意一般活泼性较强的作负极可知,A、B形成原电池时A电极附近有气泡产生,所以A作正极,说明了B的活动性大于A;
A能从D的硝酸盐溶液中能把D置换出来,说明了A的活动性大于D.
综合以上分析可知,四种金属活泼性由强到弱的顺序是C>B>A>D.
故选A.
本题解析:
本题难度:一般
4、选择题 用铜片、银片设计成如图所示的原电池.以下有关该原电池的叙述正确的是( )
A.电子通过盐桥从乙池流向甲池
B.铜导线替换盐桥,原电池仍继续工作
C.开始时,银片上发生的反应是:Ag-e?Ag+
D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同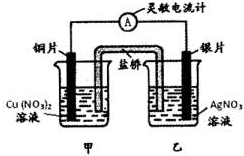
参考答案:A、原电池负极失电子,电子沿外电路导线移动,电解质溶液中是通过阴阳离子的定向移动,银电极上银离子得到电子实现,电子不通过电解质溶液移动,故A错误;
B、铜线代替盐桥,乙池是原电池,甲池是电解池发生电镀,故不是原来的原电池工作原理,故B错误;
C、银片是原电池的正极,溶液中的银离子得到电子发生还原反应,电极反应是Ag++e-=Ag,故C错误;
D、铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应都是发生了Cu+2Ag+=2Ag+Cu2+;故D正确;
故选D.
本题解析:
本题难度:一般
5、选择题 用铜片、锌片、稀H2SO4组成的原电池装置中,下列说法正确的是
A.铜片是正极
B.锌片是正极
C.铜电极失去电子
D.锌电极得到电子
参考答案:A
本题解析:
本题难度:简单