时间:2017-07-18 00:27:14
1、填空题 如图是可用于测量阿伏加德罗常数的装置示意图,其中A是纯铜片、B是石墨,插在100mLCuSO4稀溶液中,铜片、石墨与引出导线相连,引出端分别为X、Y。
(1)?当以IA的电流电解6min后,测得铜片A的质量减少了2.56g, 则图装置中的X端应与直流电的________极相连。
(2)电解后将电源反接,2IA的电流电解6min后,假设溶液体积不变,测得溶液中CuSO4物质的量浓度为0.1mol/L,则原溶液中CuSO4物质的量浓度________mol/L。溶液中H+的物质的量浓度为_______mol/L。
(3)列式计算实验测得的阿伏加德罗常数NA(用I表示)_________mol-1。(已知电子电量e=1.60×10-19C) 
2、选择题 已知在pH为4-5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8的含有Fe2(SO4)3杂质的CuSO4溶液中加入适量的黑色粉末X,充分搅拌后过滤,将滤液用如下图所示装置电解,其中某电极增重ag,另一电极上产生标准状况下的气
VmL。下列说法正确的是
[? ]
A.黑色粉末X是铁粉
B.铜电极连接电源正极
C.石墨电极上发生的反应是4OH--4e-=O2↑+2H2O
D.铜的相对原子质量的计算式是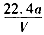
3、选择题 电解硫酸溶液时,放出25mL(标况)O2,若以等量的电量在同样条件下电解盐酸溶液,
所放出的气体的体积最接近下列数据中的 ?
A.45mL
B.50mL
C.75mL
D.100mL
4、选择题 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是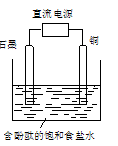
A.铜电极附近观察到黄绿色气体
B.石墨电极附近溶液呈红色
C.溶液中的Na+向石墨电极移动
D.铜电极上发生还原反应
5、填空题 Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2.电池的总反应可表示为:4Li+2SOCl2 ==="4LiCl" +S +SO2.请回答下列问题:
(1)电池的负极材料为__________,发生的电极反应为__________________;
(2)电池正极发生的电极反应为_____________________________________;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,反应的化学方程式为______________________________
(4)组装该电池必须在无水、无氧的条件下进行,原因是 ?
?.
(5)用此蓄电池电解含有0. 1 mol CuSO4和0. 1 mol NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是 ?L,将电解后的溶液加水稀释至1 L,此时溶液的pH=?。