时间:2017-07-18 00:01:29
1、选择题 两份铝屑,第一份与盐酸反应,第二份与NaOH溶液反应,产生的氢气的体积比为1:2,两份铝屑中参加反应的铝的质量比为( )
A.1:1
B.1:2
C.1:3
D.2:1
参考答案:设铝与盐酸、NaOH溶液反应生成的氢气的物质的量分别为1mol、2mol,则:
则2Al+6HCl=2AlCl3+3H2↑
2 3
23mol 1mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
23
43mol 2mol
则第一份与第二份铝屑的质量比为:(23mol×27g/mol):(43mol×27g/mol)=1:2,
故选B.
本题解析:
本题难度:简单
2、选择题 溶液中可以大量共存的一组离子是(?)
A.Al3+、 Na+、OH-、Cl-
B.H+、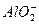 、Na+、
、Na+、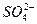
C.Mg2+、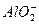 、Al3+、
、Al3+、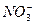
D.OH-、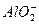 、K+、Na+
、K+、Na+
参考答案:D
本题解析:Al3+和OH-不能共存,H+和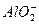 不能共存,Al3+和
不能共存,Al3+和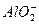 不能共存。
不能共存。
本题难度:简单
3、选择题 铝土矿的主要成分是Al2O3、Fe2O3、SiO2等,从铝土矿冶炼Al2O3的流程如下: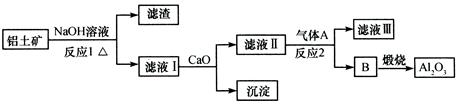
下列说法正确的是
A.气体A一定为HCl
B.滤液Ⅰ中溶质仅含NaAlO2
C.沉淀的主要成分为硅酸钙
D.反应1、反应2均不是氧化还原反应
参考答案:CD
本题解析:A.气体A一定为HCl,只要酸性强于偏铝酸均可以,最好是二氧化碳气体,不会引入新的杂质,错误;B.滤液Ⅰ中溶质仅含NaAlO2还有剩余的氢氧化钠,错误;C.硅酸钠和钙离子反应生成沉淀的主要成分为硅酸钙,正确;D.反应1、反应2均不是氧化还原反应,正确;
本题难度:一般
4、选择题 甲、乙两烧杯中各盛有1L0.6mol?L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为V(甲):V(乙)=3:4,则加入铝粉的质量为( )
A.2.7g
B.3.6g
C.5.4g
D.7.2g
参考答案:盐酸和氢氧化钠溶液中溶质的物质的量均为1L×0.6mol/L=0.6mol,
又两烧杯中分别加入等质最的铝粉,反应结束后测得生成的气体体积比为甲:乙=3:4,
设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,
则 2Al+6HCl═2AlCl3+3H2↑
63
0.6mol x
解得:x=0.3mol,
一定条件下,气体的物质的量之比等于体积之比为3;4,
则碱与金属铝反应生成的氢气的物质的量为0.4mol,
碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,
则 2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
y 0.4mol
解得:y=0.83mol,
则铝的质量为0.83mol×27g/mol=7.2g,
故选D.
本题解析:
本题难度:一般
5、填空题 铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。铝土矿的主要成分是Al2O3和SiO2及其它不溶于NaOH溶液的杂质。从铝土矿中提炼Al2O3的流程如下: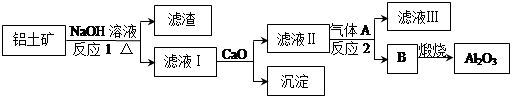
回答下列问题:
(1)写出反应1的化学方程式?;
(2)滤液Ⅰ中加入CaO生成的沉淀是?,反应2的离子方程式为?;
(3)电解制铝的化学方程式是?,以石墨为电极,阳极产生的混合气体的成分是?。
参考答案:(1)2NaOH+SiO2=Na2SiO3+H2O(2分) 2NaOH+Al2O3=2NaAlO2+H2O(2分)
(2)CaSiO3(1分)?
?2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-?或AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(2分)
(3)2Al2O3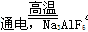 4Al+3O2↑(2分) ?O2、CO2(CO)(2分)
4Al+3O2↑(2分) ?O2、CO2(CO)(2分)
本题解析:(1)酸性氧化物、两性氧化物都能溶于强碱溶液,生成盐和水;(2)氧化钙是碱性氧化物,与水反应生成氢氧化钙,钙离子与硅酸根离子结合成硅酸钙沉淀;偏铝酸盐溶液通入少量或过量CO2,可以制取氢氧化铝沉淀;(3)电解熔融氧化铝可制取铝;阳极反应式为2O2——2e—=O2↑,高温下C与O2反应生成CO2或CO。
本题难度:一般