时间:2017-07-18 00:01:29
1、选择题 氧化亚铁粉末和铝粉配成铝热剂,分成两等份。一份在高温下恰好完全反应后,在与盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体的质量比是?
A.1:1? B.2:3? C.? 3:2?D 28:9
参考答案:A
本题解析:在铝热反应中Al失去的电子的物质的量与Fe得到的电子的物质的量相等。其置换出的Fe再与酸反应,产生的氢气得到的电子的物质的量与Fe得到的电子的物质的量相等,也就等于Al失去的电子的物质的量。在氧化亚铁粉末和铝粉配成铝热剂与足量的烧碱溶液中充分反应时Al失去的电子的物质的量与氢气得到的电子的物质的量相等。由于两份含有的Al相等,所以失去的电子的物质的量相等,因此两份产生的氢气的物质的量也相等。故选项是A。
本题难度:一般
2、选择题 wg铁粉和铝粉的混合物,和过量的?NaOH反应,然后过滤,将沉淀完全收集后,放蒸发皿中加热,直至被加热的物质质量不再变化,取出蒸发皿中的物质称量仍为wg.求原混合物中铝粉的质量分数是( )
A.30%
B.50%
C.70%
D.90%
参考答案:wg铁粉和铝粉的混合物,和过量的NaOH反应,然后过滤,滤渣为Fe,
放入蒸发皿中完全灼烧后最终应生成Fe2O3,
取出蒸发皿中的物质称量仍为wg,
则铝粉的质量等于Fe2O3中O元素的质量,
则有原混合物中铝粉的质量分数为:3×163×16+2×56×100%=30%,
故选A.
本题解析:
本题难度:简单
3、选择题 下列关于金属铝的叙述中,说法正确的是( )
A.Al是地壳中含量最多的元素
B.因为Al在常温下与浓硫酸不反应,所以可用铝槽车运输浓硫酸
C.与Al反应产生H2的溶液一定呈酸性
D.Al箔在空气中受热可熔化,由于氧化膜的存在,熔化的Al并不滴落
参考答案:A、地壳中元素含量最高的是氧元素,铝是地壳中元素含量最高的金属元素,故A错误;
B、Al在常温下与浓硫酸发生钝化现象,发生化学反应,生成一层致密的氧化物保护膜,阻止内部金属与浓硫酸继续反应,故B错误;
C、与Al反应产生H2的溶液可能呈酸性,也可能呈碱性,故C错误.
D、铝和氧气反应在Al箔表面生成了致密的氧化铝膜,氧化铝的熔点高于铝的熔点,加热铝箔的时铝熔化了,但是氧化铝膜兜着熔化的铝不会滴落,故D正确.
故选D.
本题解析:
本题难度:简单
4、选择题 下列反应的离子方程式正确的是
A.石英与烧碱溶液共热:SiO2+2OH-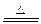 SiO32-+H2O
SiO32-+H2O
B.在氯化铝溶液中滴加过量的氨水:Al3++4 OH-=[Al (OH)4]-
C.在氢氧化钠溶液中通入过量的CO2:2OH-+CO2=CO32-+H2O
D.在稀盐酸中滴加过量的硅酸钠溶液:SiO32-+2H++H2O=H4SiO4↓
参考答案:A、D。
本题解析:A体现出SiO2酸性氧化物的性质,D为强酸制弱酸,二者都是正确的。B项有两个错误:氨水是弱碱,不能拆开写;因为氢氧化铝不溶于氨水,因此,无论氨水过量与否,都生成氢氧化铝,不能生成[Al (OH)4]-。C项应该生成碳酸氢根离子,而不是CO32-。
本题难度:简单
5、选择题 将等体积的AlCl3溶液和NaOH溶液混合后,沉淀物中铝元素的物质的量与溶液中铝元素的物质的量相等,则原AlCl3溶液与NaOH溶液的物质的量浓度之比可能是(? )
A.1:3
B.2:5
C.1:5
D.2:7
参考答案:D
本题解析:由于氢氧化铝是两性氢氧化物,能溶于氢氧化钠溶液中,所以溶液中的铝元素,可以是铝离子,也可以是AlO2-,因此根据反应的方程式Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O可知,如果氯化铝过量,则原AlCl3溶液与NaOH溶液的物质的量浓度之比2:3;如果氢氧化钠过量,生成偏铝酸钠,则原AlCl3溶液与NaOH溶液的物质的量浓度之比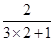 =2:7,答案选D。
=2:7,答案选D。
点评:由于氢氧化铝是两性氢氧化物,能溶于氢氧化钠溶液中,所以在计算生成的氢氧化铝时,应该注意如果氢氧化钠过量时生成的氢氧化铝会溶剂在过量的氢氧化钠中,因此本题应该有2种情况。
本题难度:一般