时间:2017-07-10 20:27:50
1、填空题 硫酸是强酸,中学阶段将硫酸在水溶液中看做完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为H2SO4=H++HSO4-,HSO4- H++SO42-。
H++SO42-。
请回答下列有关问题:
(1)Na2SO4溶液呈________(填“弱酸性”、“中性”或“弱碱性”),其理由是___ _______________________________________。(用离子方程式表示)。
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为_________________________。
(3)在0.10 mol·L-1的Na2SO4溶液中,下列离子浓度的关系正确的是________(填写编号)。
A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4)
B.c(OH-)=c(HSO4-)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(4)若25℃时,0.10 mol·L-1的NaHSO4溶液中c(SO42-)=0.029 mol·L -1,则0.10 mol·L-1的H2SO4溶液中c(SO42-)________0.029 mol·L-1(填“<”、“>”或“=”),其理由是__________________________________________________________________。
(5)或25℃时,0.10 mol·L-1H2SO4溶液的pH=-lg 0.11,则0.10 mol·L-1H2SO4溶液中c(SO42-)=________ mol·L-1。
参考答案:(1)弱碱性? SO42-+H2O HSO4-+OH-
HSO4-+OH-
(2)Ba2++HSO4-=BaSO4↓+H+
(3)BCD
(4)< H2SO4=HSO4-+H+,电离出的H+抑制HSO4-的电离
(5)0.01
本题解析:(1)由题中信息可得,硫酸钠是弱酸强碱盐,易水解生成硫酸氢钠:Na2SO4+H2O?NaHSO4+NaOH,所以硫酸钠溶液呈弱碱性。(2)硫酸氢根离子部分电离,是弱酸根离子,硫酸与氯化钡反应的离子方程式为Ba2++HSO4-=BaSO4↓+H+。(3)A项,由题意知,硫酸钠溶液中存在的阳离子:Na+、H+,阴离子:SO42-、OH-、HSO4-,溶液中不存在H2SO4,A项错误;B项,物料守恒式为c(Na+)=2c(SO42-)+2c(HSO4-),电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-),两式相减,得质子守恒式:c(OH-)=c(H+)+c(HSO4-),B、C、D项正确。(4)硫酸氢钠溶液中存在:HSO4- H++SO42-;硫酸溶液中存在:H2SO4=H++HSO4-,HSO4-
H++SO42-;硫酸溶液中存在:H2SO4=H++HSO4-,HSO4- H++SO42-,硫酸第一步电离出来的H+对第二步电离有抑制作用,使平衡向左移动,故同浓度的硫酸溶液中c(SO42-)小于硫酸氢钠溶液中的c(SO42-)。
H++SO42-,硫酸第一步电离出来的H+对第二步电离有抑制作用,使平衡向左移动,故同浓度的硫酸溶液中c(SO42-)小于硫酸氢钠溶液中的c(SO42-)。
(5)0.10 mol·L-1H2SO4溶液中c(H+)=0.11 mol·L-1,由于硫酸在水中第一步完全电离,第二步部分电离,所以c(SO42-)=0.01 mol·L-1。
本题难度:一般
2、选择题 已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2mol·L-1HF溶液中加入1 L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是(?)
A.25℃时,0.1 mol·L-1HF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生
D.加入CaCl2溶液后体系中的c(H+)浓度不变
参考答案:C
本题解析:A、电离常数Ka(HF)=3.6×10-4,HF为弱电解质,不能完全电离,25℃时,0.1mol?L-1HF溶液中c(H+)=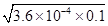 mol/L=6×10-3mol/L,pH>1,故A错误;B、溶度积只受温度的影响,不随浓度的变化而变化,故B错误;C、向1L?0.2mol?L-1HF溶液中加入1L?0.2mol?L-1CaCl2溶液,混合后,c(H+)=c(F-)=
mol/L=6×10-3mol/L,pH>1,故A错误;B、溶度积只受温度的影响,不随浓度的变化而变化,故B错误;C、向1L?0.2mol?L-1HF溶液中加入1L?0.2mol?L-1CaCl2溶液,混合后,c(H+)=c(F-)=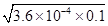 mol/L=6×10-3mol/L,c(Ca2+)=0.1mol/L,c2(F-)×c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,该体系中有CaF2沉淀产生,故C正确;D、溶液中存在HF
mol/L=6×10-3mol/L,c(Ca2+)=0.1mol/L,c2(F-)×c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,该体系中有CaF2沉淀产生,故C正确;D、溶液中存在HF H++F-,CaF2(s)
H++F-,CaF2(s) Ca2+(aq)+2F-(aq),加入CaCl2溶液后,Ca2+浓度增大,平衡向生成沉淀的方向移动,则F-浓度减小,促进HF的电离,c(H+)浓度增大,故D错误,答案选C。
Ca2+(aq)+2F-(aq),加入CaCl2溶液后,Ca2+浓度增大,平衡向生成沉淀的方向移动,则F-浓度减小,促进HF的电离,c(H+)浓度增大,故D错误,答案选C。
本题难度:一般
3、简答题 (4分) 一定温度下,A、B两瓶乙酸的浓度分别是1 mol/L和0.1 mol/L,则A、B两瓶乙酸溶液中[ H+ ]之比 10(填“<”、“>”或“=”),并简述理由 。
参考答案:< 乙酸是弱酸,稀释促进电离
本题解析:如果两种溶液都是完全电离的,那么A溶液中的 H+是B溶液的10倍,但是乙酸是弱酸,电离程度与溶液的浓度有关,溶液越稀电离程度越大,所以0.1 mol/L的乙酸电离程度要大,故A、B两溶液中 H+浓度之比小于10。
考点:电离平衡的移动和离子浓度。
本题难度:一般
4、选择题 已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O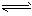 HCl+HClO,HClO
HCl+HClO,HClO 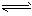 H++ClO-。达平衡后要使HClO浓度增加,可加入
H++ClO-。达平衡后要使HClO浓度增加,可加入
[? ]
A. SO2
B.Na2CO3
C.HCl
D.NaOH
参考答案:B
本题解析:
本题难度:一般
5、选择题 常温下,pH=12的氨水中存在以下电离平衡:
NH3·H2O NH4+ +OH-。往其中加入少量0.01 mol·L-1NaOH溶液,保持不变的是(? )
NH4+ +OH-。往其中加入少量0.01 mol·L-1NaOH溶液,保持不变的是(? )
A.c(NH4+)
B.c(OH-)
C.c(NH3·H2O)
D.c(NH4+)·c(OH-)
参考答案:B
本题解析:pH=12的氨水中c(OH-)=10-2 mol·L-1,故再加入等浓度的NaOH溶液,c(OH-)不会改变;由于溶液体积变大,故c(NH4+)、c(NH3·H2O)、c(NH4+)·c(OH-)都会变小,故A、C、D错误
本题难度:一般