时间:2017-07-10 20:16:37
1、选择题 室温下向10mLpH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.再加入10mLpH=11的NaOH溶液,混合液pH=7
D.溶液中
| c(CH3COO-) c(CH3COOH)?c(OH-) |
参考答案:A、因醋酸溶液中加水稀释,促进电离,则液中导电粒子的数目增多,故A错误;
B、加水稀释时,醋酸的电离平衡正移,电离程度增大,溶液的体积增大的倍数大于n(H+)增加的倍数,则c(H+)减小,故B错误;
C、等体积10mLpH=3的醋酸与pH=11的NaOH溶液混合时,醋酸的浓度大于0.001mol/L,醋酸过量,则溶液的pH<7,故C错误;
D、因为c(CH3COO-)c(CH3COOH)?c(OH-)=c(CH3COO-)×c(H+)c(CH3COOH)×KW=KaKw,温度不变,Ka、Kw都不变,则c(CH3COO-)c(CH3COOH)?c(OH-)不变,故D正确;
故选D.
本题解析:
本题难度:一般
2、填空题 (1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈?(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) ?c(CH3COO-)(填“ >” 或“=”或“<” )。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈?,
溶液中c(Na+) ?c(CH3COO-)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈?,醋酸体积?氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)?氢氧化钠溶液中c(OH-),m与n的大小关系是m?n。
参考答案:(1)碱性,>;?(2)酸性,<;
(3)中性,>;?(4)<,>。
本题解析:(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,生成了醋酸钠溶液,为强碱弱酸盐,醋酸根水解呈碱性,由于醋酸根水解,所以c(Na+)>c(CH3COO-);(2)醋酸为弱酸,故pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液后生成了醋酸钠和醋酸的混合溶液,并且醋酸的量远远大于醋酸钠的量,故其该混合溶液呈酸性,根据电荷守恒可以知道c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因为溶液为酸性,所以
c(H+)>c(OH-),故c(Na+) <c(CH3COO-);(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,根据电荷守恒可以知道c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故混合后溶液呈中性,醋酸体积大于氢氧化钠溶液体积;(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,由于醋酸为弱酸,所以醋酸溶液中c(H+)小于氢氧化钠溶液中c(OH-),m与n的大小关系是m大于n。
点评:本题考查了强弱电解质,涉及考查了电荷守恒,离子浓度的比较,该题的难度设计比较合理,是一道不错的填空题。
本题难度:一般
3、选择题 下列事实一定能说明HNO2为弱电解质的是
①常温下Na NO2溶液的PH>7?②10mL1mol/L HNO2恰好与10mL1mol/LNaOH完全反应③HNO2与NaCl不能反应④0.1mol/L HNO2溶液的PH=2.1
A:①②③④? B:②③④? C:①④? D:②④
参考答案:C
本题解析:略
本题难度:一般
4、选择题 常温下,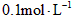 某一元酸(HA)溶液中
某一元酸(HA)溶液中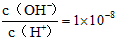 ,下列叙述正确的是
,下列叙述正确的是
[? ]
A.该溶液中由水电离出的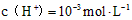
B.该溶液中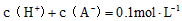
C.该溶液与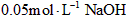 溶液等体积混合后所得溶液中
溶液等体积混合后所得溶液中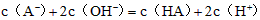 ?
?
D.向该溶液中加入一定量的水,溶液中离子的浓度均减小
参考答案:C
本题解析:
本题难度:一般
5、选择题 一定温度下,下列溶液的离子浓度关系式正确的是
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D.pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
参考答案:D
本题解析:A、H2S溶液中,存在H2S  ?H+ + HS-、HS-
?H+ + HS-、HS- ?H+ + S2-、H2O
?H+ + S2-、H2O H+ + OH-,根据上述反应知,pH=5的H2S溶液中,c(H+)=1×10—5 mol·L—1> c(HS-),错误;B、一水合氨为弱电解质,加水稀释,促进其电离,pH变化比强碱小。pH=a的氨水溶液,稀释10倍后,其pH=b,则a<b+1,错误;C、根据电荷守恒知,pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)+2 c( C2O42-),错误;D、酸性:CH3COOH>H2CO3>HClO,根据盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,物质的量浓度相同时,溶液的碱性越强,PH越大,故pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③,正确。
H+ + OH-,根据上述反应知,pH=5的H2S溶液中,c(H+)=1×10—5 mol·L—1> c(HS-),错误;B、一水合氨为弱电解质,加水稀释,促进其电离,pH变化比强碱小。pH=a的氨水溶液,稀释10倍后,其pH=b,则a<b+1,错误;C、根据电荷守恒知,pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)+2 c( C2O42-),错误;D、酸性:CH3COOH>H2CO3>HClO,根据盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,物质的量浓度相同时,溶液的碱性越强,PH越大,故pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③,正确。
本题难度:一般