时间:2017-07-10 20:11:51
1、计算题 25°C时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH="b" 的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白:
(1)a值可否等于3?(填“可”或“否”),其理由是?
(2)a值可否等于5?(填“可”或“否”),其理由是?
(3)a的取值范围是?
参考答案:(1)否,若a=3,则b=6,碱溶液显酸性,与题意不符
(2)否,若a=5,C(H+)=10—5 mol/L,则b=5,c(OH-)=10—4 mol/L,
Va/Vb= c(OH-)/ c(H+)>1,不合题意
(3)Va/Vb= c(OH-)/ c(H+)=10(a+b-14)<1 ,故(a+b-14)<0,而a=0.5b,即3a<14,a<14/3,pH=b=2a>7,所以3.5<a<14/3。
本题解析:考查pH的有关计算。
(1)如果a=3,则根据a=0.5b可知,b=6。由于在常温下碱溶液的pH一定是大于7的,因此假设是不能成立的。
(2)如果a=5,则根据a=0.5b可知,b=10。此时c(H+)=10—5 mol/L,c(OH-)=10—4 mol/L,
Va/Vb= c(OH-)/c(H+)>1,不合题意.因此假设是不能成立的。
(3)根据Va/Vb= c(OH-)/c(H+)可知,Va/Vb= 10(a+b-14)<1 ,故(a+b-14)<0。由于a=0.5b,因此3a<14,a<14/3,pH=b=2a>7,所以3.5<a<14/3。
本题难度:一般
2、选择题 现有浓度为1 mol/L的五种溶液:①HCl,②H2SO4,③CH3COOH,④NH4Cl ⑤NaOH,由水电离出的C(H+)大小关系正确的是
A.④>③>①=⑤>②
B.①=②>③>④>⑤
C.②>①>③>④>⑤
D.④>③>①>⑤>②
参考答案:A
本题解析:水是弱电解质,存在电离平衡H2O H++OH-。因此酸或碱都是抑制水的电离,而某些发生水解的盐可以促进水的电离。且氢离子或OH-浓度相等时,对水的电离平衡是等效的。由于盐酸、硫酸、氢氧化钠是强碱,醋酸是弱酸,氯化铵水解,因此由水电离出的C(H+)大小关系是④>③>①=⑤>②,答案选A。
H++OH-。因此酸或碱都是抑制水的电离,而某些发生水解的盐可以促进水的电离。且氢离子或OH-浓度相等时,对水的电离平衡是等效的。由于盐酸、硫酸、氢氧化钠是强碱,醋酸是弱酸,氯化铵水解,因此由水电离出的C(H+)大小关系是④>③>①=⑤>②,答案选A。
点评:外界条件对电离平衡的影响,也遵循勒夏特例原理,据此可以进行有关的判断。
本题难度:一般
3、实验题 某学生用已知物质的量浓度的盐酸测定未知物质的量浓度的NaOH溶液时选择甲基橙作指示剂,请填写下列空白:
(1)配制待测液:用含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制500mL溶液。除烧杯、量筒、胶头滴管和玻璃棒外,还需要的玻璃仪器是?。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________。
A.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
(3)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH 溶液的体积来 | 0.1000mol/L盐酸的体积/mL+ | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.28 | 26.28 |
| 第二次 | 25.00 | 1.55 | 30.30 | 28.75 |
| 第三次 | 25.00 | 0.20 | 26.42 | 26.22 |
参考答案:(每空2分,共10分)
(1)500mL容量瓶(容量瓶不注明规格不得分)?(2分) ?
(2)? A? (2分)
(3) V="26.25mL" , c(NaOH)=0.1000mol·L-1×26.25mL/25.00mL="0.1050mol/L" (若为0.105 mol/L 得1分,其他答案不得分)? (2分)
(4) 橙? (2分),半分钟不变色 (2分)
本题解析:(1)配制溶液所需的玻璃仪器有:烧杯、量筒、胶头滴管、玻璃棒和容量瓶。
(2)A项:开始仰视读数,盐酸的量偏小,滴定结束时俯视读数,盐酸的量偏大,故最终盐酸用量偏小,故使所测NaOH溶液的浓度数值偏低,故正确。
(3)第二次与其它相差太大,舍去,用第一次和第三次的数量进行计算, V="26.25mL" , c(NaOH)=0.1000mol·L-1×26.25mL/25.00mL=0.1050mol/L。
(4)滴定结束的判断。盐酸滴定氢氧化钠溶液由黄色变橙色,并且半分钟不变色为止。
点评:本题考查了酸碱中和滴定,难度不大,注意酸碱滴定管的小刻度在上,大刻度在下,明确俯视时溶液的体积偏大还是偏小。
本题难度:一般
4、选择题 将pH=5的H2SO4溶液稀释1 000倍后,溶液中SO浓度与H+浓度的比值约为
A.1∶10
B.1∶1
C.1∶2
D.1∶20
参考答案:D
本题解析:本题一定要注意H+浓度最终接近10—7mol/L,而c(SO)最终为 mol/L
mol/L
本题难度:一般
5、选择题 在下列各微粒中,能使水的电离平衡向正方向移动,而且溶液的pH小于7是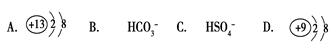
参考答案:A
本题解析:
正确答案:A
A、Al3+水解呈酸性,促进水电离,pH小于7,A正确;
B、水解,促进水电离,但pH大于7;
C、强电解质,抑制水电离;
D、F―水解,促进水电离,水解后,pH大于7.
本题难度:一般