时间:2017-07-10 20:04:08
1、选择题 向5mLNaCl溶液里滴 入一滴AgNO3溶液,出现白色沉淀,继续加入一
入一滴AgNO3溶液,出现白色沉淀,继续加入一 滴KI溶液,沉淀变为黄色,再加入一滴Na2S溶液,沉淀又变为黑色,据此分析此三种沉淀物的KSP的一般关系为()
滴KI溶液,沉淀变为黄色,再加入一滴Na2S溶液,沉淀又变为黑色,据此分析此三种沉淀物的KSP的一般关系为()
A.KSP(AgCl)=KSP(AgI)=KSP(Ag2S)
B.KSP(AgCl)<KSP(AgI)<KSP(Ag2S)
C.KSP(AgCl)>KSP(AgI)>KSP(Ag2S)
D.因发生特殊反应,无法判断
2、选择题 下列有关实验的叙述正确的是
A.已知Cu2O+2H+=Cu2++Cu+H2O,氢气还原氧化铜后生成的红色固体能完全溶于稀硝酸,说明还原产物是铜
B.在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为末温度
C.仅用淀粉溶液、稀硫酸、碘水、新制氢氧化铜四种试剂可完成淀粉水解产物及水解程度检验的探究实验
D.向盛有少量Mg(OH )2悬浊液的试管中滴加氯化铵溶液,可以看到沉淀溶解
3、填空题 如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为________________.
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=______________
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是________
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表? 
根据上表数据判断下列说法正确的是________.
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50?mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
4、选择题 室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示。已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是 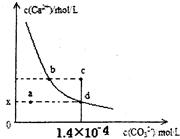
A.x的数值为2×10-5
B.c点时有CaCO3生成
C.加入蒸馏水可使溶液由d点变成 a点
D.b点与d点对应的溶度积相等
5、填空题 (1)研究证明使用氯气作自来水消毒剂时,氯气会与水中有机物反应,生成CHCl3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发出多种自来水的新型消毒剂。下列物质不能作自来水消毒剂的是
_________ (填序号)。
A.硫酸铜 B.二氧化氯 C.臭氧 D.硫酸亚铁
(2)高铁(VI)酸盐(如Na2FeO4)是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物法(干法)等。湿法是在碱性溶液中用次氯酸氧化铁盐(Ⅲ),写出该法的离子方程式:______________________。
(3)用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质为KOH溶液,放电时的总反应:
3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。
①写出正极发生的电极反应式:_________________。
②用高铁(VI)电池作电源,以石墨作阳极,以Cu作阴极,对足量KOH溶液进行电解,当电池中有0.2 mol K2FeO4反应时,则在电解池中生成______L H2(标准状况)。
③下表列出了某厂排放的废水中锌的含量及国家环保标准值的有关数据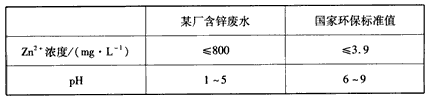
该厂只用调节pH的方法处理废水,当调整pH=7时,此时废水中Zn2+的浓度为__________mg/L,_______ (填“符合”或“不符合”)国家环保标准(常温下,Ksp[Zn(OH)2]=1.2×10-17)。