时间:2017-07-10 19:59:22
1、填空题 某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
(1)X极与电源的 (填“正”或“负”)极相连,氢气从 (选填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为 (填“阴离子”或“阳离子”,下同)交换膜,N为 交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为 。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是 ,转移的电子数为 。
2、填空题 (16分)电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,
实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X电极上的电极反应是?,
在X极附近观察到的现象是?。
②Y电极上的电极反应?,
检验该电极反应产物的方法是?。
(2)若X和Y仍均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为_____
_________________________。通过一段时间后,向所得溶液中加入16gCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为__________。?
(3)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是___________,电极反应式是_________________________。
②Y电极的材料是___________,电极反应式是_________________________。
(说明:杂质发生的电极反应不必写出)
3、选择题 (2014届江西省九江市七校高三第二次联考化学试卷)
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下图为RFC工作原理示意图,有关说法正确的是(?)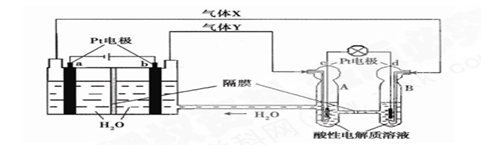
A.当有0.1mol电子转移时,a极产生1.12L O2(标准状况下)
B.b极上发生的电极反应是:4H2O + 4e- = 2H2↑+ 4OH-
C.d极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O
D.c极上进行还原反应,B中的H+可以通过隔膜进入A
4、实验题 碘酸钾(KIO3)晶体是我国规定的食盐加碘剂。它通常是以碘为原料与过量KOH溶液通过下列反应制得:3I2+6KOH=5KI+KIO3+3H2O,再将KI和KIO3的混合溶液电解,将其中的I―转化为IO3―,装置如图。
(1)在反应3I2+6KOH=5KI+KIO3+3H2O中,氧化剂和还原剂的物质的量之比为?。
(2)电解前,将KI和KIO3混合溶液加入阳极区;将氢氧化钾溶液加入阴极区。电解槽用水冷却。电解时,阳极上的电极反应?;阴极上得到的气体产物为?;
(3)某同学查资料获知:KIO3在酸性介质中与碘化物作用生成单质碘,该反应的离子反应方程式为?,为确定电解是否完成,需检验阳极区电解液中是否含有I―,该同学选用淀粉溶液和稀硫酸进行实验,其它仪器及用品自选,请完成其方案:
| 实验操作 | 现象及结论 |
| ? | ? |

5、填空题 电解原理在化学工业中有广泛应用。右图表示一个电解池,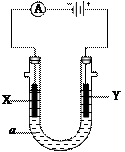
装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同
时在两边各滴入几滴酚酞试液,则
①Y电极上的电极反应式为?,
检验该电极反应产物的方法是?。
②电解池中X极上的电极反应式为?。
在X极附近观察到的现象是?。
③电解一段时间后,若收集到H2为2L,则同样条件下收集的Cl2?2L(填“>”“<”“=”),
原因是?。
(2)如果在铁件的表面镀铜防止铁被腐蚀,电解液a选用CuSO4溶液,请回答:
①X电极对应的金属是____?__(写元素名称),其电极反应式?。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二
者质量差为5.12 g,则电镀时电路中通过的电子为________________mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
?。