时间:2017-07-10 19:50:29
1、选择题 液氨与水相似,存在着微弱的电离:2NH3 NH4++NH2-,- 50℃时,两种离子的平衡浓度均为
NH4++NH2-,- 50℃时,两种离子的平衡浓度均为
1×10-15 mol/L,下列有关液氨的离子积及其电离平衡的叙述中错误的是
[? ]
A.此温度下,液氨的离子积等于1×10 -30
B.在液氨中放入NaNH2,则液氨的离子积数值将增大
C.此温度下,在液氨中加入NaNH2,则液氨中c(NH4+)<1×10-15 mol/L
D.在液氨中加入NH4Cl,则液氨中c(NH4+)将大于c(NH2-)
2、选择题 根据下表提供的数据,下列判断正确的是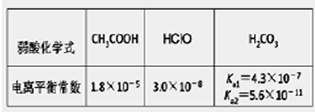
A.等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有: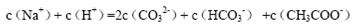
B.常温下,已知酸H2A存在如下平衡: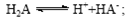 ;
;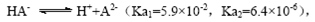 ,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
C.相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c(Na+)> c(ClO-)> c(CH3COO-)> c(OH-)>c(H+)
D.常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5
3、选择题 常温下,有关①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液,四种溶液的比较中,正确的是
A.水电离的c(H+):①=②=③=④
B.将②、③溶液混合后pH=7,则消耗溶液的体积:②=③
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向溶液中加入100mL水后,溶液的pH:③>④>①>②
4、填空题 物质在水溶液中存在的电离平衡、水解平衡和沉淀溶解平衡,都可看作化学平衡。请根据所学知识回答:
(1)在0.1mo1·L-1的NaHSO3溶液中存在的各种平衡体系为(用离子方程式表示):?、?、?。
已知该溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO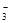 )>c(SO
)>c(SO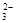 )>c(H2SO3)。则该溶液中c(H+)?c(OH-) (填“大于”、“小于”或“等于”),简述理由:?.
)>c(H2SO3)。则该溶液中c(H+)?c(OH-) (填“大于”、“小于”或“等于”),简述理由:?.
(2)常温下,某水溶液中存在的离子有:Na+、A—、H+、OH—,若该溶液由0.1mo1.L-1的HA溶液和0.1mol.L-1的NaOH溶液等体积混合而得,则溶液的pH ?(填“大于”、“小于”或“等于”)7,理由是?。
5、计算题 在25℃下,将a mol·L-1的氨水与0.01mol·L-1的盐酸等体积混合后,溶液中c(NH4+)=c(Cl-)。试用含a的代数式计算NH3·H2O的电离常数Kb。