时间:2017-07-10 19:50:29
1、填空题 醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+? ΔH>0
CH3COO-+H+? ΔH>0
(1)常温下,pH=5醋酸溶液中,c(CH3COO-)=______mol/L(精确值,要求列式不必化简);
(2)下列方法中可以使0.10 mol·L-1 CH3COOH的电离程度增大的是?
a.加入少量0.10 mol·L-1稀盐酸? b.加热CH3COOH溶液? c.加水稀释至0.010 mol·L-1?
d.加入少量冰醋酸? e.加入少量氯化钠固体? f.加入少量0.10 mol·L-1 NaOH溶液
(3)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸)(填“大于”、“小于”或“等于”)
(4)用NaOH溶液分别滴定20.00mL0.1mol/L盐酸和20.00mL0.1mol/L醋酸溶液,得到如图所示两条滴定曲线,用NaOH溶液滴定醋酸溶液的曲线是?(填“图1”或“图2”)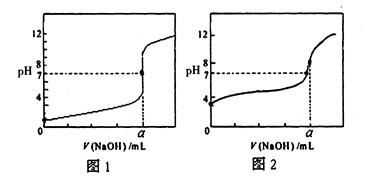
(5)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(6)下图表示溶液中c(H+)和c(OH-)的关系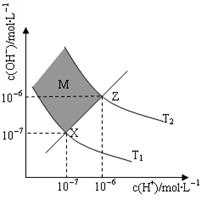
①M区域内(阴影部分)任意点c(H+)______c(OH-)(填“大于”、“小于”或“等于”)
②在T2温度下,将pH=9 NaOH溶液与pH=4 HCl溶液混合,若所得混合溶液的pH=7,则NaOH溶液与HCl溶液的体积比为?。(混合后溶液体积的变化忽略不计)
参考答案:(1)10-5-10-9(2)bcf(3)小于(4)图2
(5)c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-)(6)①小于 ;②1:9
本题解析:(1)在 pH=5的稀醋酸溶液中,c(H+)=10-5mol/L,c(OH-)=10-9mol/L,根据溶液电荷守恒可知c(H+)=c(CH3COO-)+c(OH-),则c(CH3COO-)=(10-5-10-9)mol/L(2)加热、加水稀释、加入碱性物质均能使电离平衡向右移动,故答案为?bcf;(3)醋酸是弱酸,随着它和金属的反应,电离平衡不断地向右移动,会电离出更多的氢离子,所以醋酸产生的氢气体积较大,故答案为小于;(4)滴定开始时0.002mol/L盐酸pH=3,0.002mol/L醋酸pH>3,所以滴定醋酸的曲线是图2;(5)将0.1mol/L盐酸和0.1mol/L醋酸钠溶液混合,反应生成醋酸,如等体积混合物,溶液呈酸性,溶液呈中性,应加入少量盐酸,生成醋酸,则c(Na+)>c(CH3COO-)>c(Cl-)溶液恰好呈中性,氢离子和氢氧根的浓度一定相等,c(H+)=c(OH-),则有c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-);(6)①由图可知,ZX线表示c(H+)=c(OH-),则ZX线上部分表示c(H+)<c(OH-);②由图知,在T2温度下,水的离子积为:c(H+)?c(OH-)=10-12,此温度下pH=9的NaOH溶液中c(OH-)=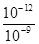 =10-3mol/L,pH=4的HCl溶液c(H+)=10-4mol/L,若所得混合溶液的pH=7,则反应后的溶液的c(OH-)=
=10-3mol/L,pH=4的HCl溶液c(H+)=10-4mol/L,若所得混合溶液的pH=7,则反应后的溶液的c(OH-)=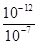 =10-5mol/L,即
=10-5mol/L,即 =10-5 mol/L,得V(NaOH):V(HCl)=1:9。
=10-5 mol/L,得V(NaOH):V(HCl)=1:9。
本题难度:简单
2、选择题 化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是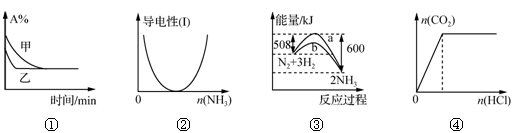
A.图①表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
B.图②表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
C.图③表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
D.图④表示一定浓度Na2CO3溶液中滴加盐酸,生成CO2与滴加盐酸物质的量的关系
参考答案:C
本题解析:A、该反应为体积缩小的反应,增大压强,平衡正移,但甲乙两曲线平衡状态相同,故该图不应是压强的影响,而应是催化剂的影响,错误;B、乙酸为弱电解质,其中通入氨气后导电能力逐渐增强,错误;C、由图可知,反应物的总能量大于生成物的总能量,为放热反应,b曲线表示反应的活化能降低,说明加入了催化剂,正确;D、碳酸钠溶液中加入盐酸,刚开始不会生成二氧化碳气体,错误;故本题选择C。
考点:化学图像的描述
本题难度:困难
3、选择题 在100 mL 0.1 mol·L-1的CH3COOH溶液中欲使CH3COOH 的电离度增大且c(H+)降低,可采用的方法是?
[? ]
参考答案:B
本题解析:
本题难度:一般
4、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞溶液显红色的溶液中:K+、Na+、Cu2+、
B.加入过量NaOH溶液或少量稀H2SO4时,都能产生白色沉淀的溶液:Al3+、Ba2+、Cl-、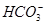
C.水电离产生的c(H+)=10-13mol·L-1的溶液中:Na+、Cl-、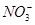 、
、
D.0.1 mol·L-1HNO3溶液中:Mg2+、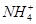 、Fe2+、Cl-
、Fe2+、Cl-
参考答案:C
本题解析:滴入酚酞溶液显红色的溶液呈碱性,Cu2+不能存在,A项错误;虽然加入过量NaOH溶液或少量稀H2SO4时,都能产生白色沉淀,但是Al3+、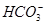 不能共存,B项错误;Na+、Cl-、
不能共存,B项错误;Na+、Cl-、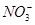 、
、 无论在酸性或碱性条件下都能共存,C项正确;在HNO3溶液中Fe2+被氧化,D项错误。
无论在酸性或碱性条件下都能共存,C项正确;在HNO3溶液中Fe2+被氧化,D项错误。
本题难度:一般
5、选择题 已知25℃时,有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 电离平衡常数 1.8×10-5 4.9×10-10 K1=4.3×10-7?K2=5.6×10-11 |
参考答案:A.根据表中数据可知溶液酸性:CH3COOH>H2CO3>HCN>HCO3-,酸越弱,对应的盐水解程度越大,溶液碱性越强,
则25℃时,0.1mol/L的各溶液的pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故A错误;
B.根据pH=-lg[c(H+)]可知,25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等,故B正确;
C.若同浓度的醋酸和氢氧化钠等体积混合,溶液中存在:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液pH=8,
则c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=1.0×10-6mol/L-1.0×10-8mol/L=9.9×10-7mol/L,故C正确;
D.NaHCO3和Na2CO3混合溶液中存在电荷守恒,即c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D正确.
故选A.
本题解析:
本题难度:简单