时间:2017-07-10 19:40:53
1、选择题 下列分子晶体:
①HCl? ②HBr? ③HI ④CO? ⑤N2? ⑥H2
熔沸点由高到低的顺序是?
A.①②③④⑤⑥
B.③②①⑤④⑥
C.③②①④⑤⑥
D.⑥⑤④③②①
参考答案:C
本题解析:分子晶体中熔沸点的大小一般依据分子量的大小数序一致。故选C。
点评:本题考查的是分子晶体的性质的相关知识,题目难度不大,掌握分子晶体中熔沸点的大小一般依据分子量的大小数序一致的解题的关键。
本题难度:一般
2、选择题 下列叙述中不正确的是
[? ]
A.凡有规则外形的固体一定是晶体
B.晶体尽量采取紧密堆积方式,以使其变得比较稳定
C.晶体内部的微粒按一定规律做周期性重复排列
D.晶体的结构决定了晶体的性质
参考答案:A
本题解析:
本题难度:简单
3、选择题 在石墨晶体里,每一层由无数个正六边形构成,同一层内每个碳原子与相邻的三个碳原子以C-C键结合,则石墨晶体中碳原子数与C-C键数之比为? (? )
A.1:1
B.2:l
C.2:3
D.3:2
参考答案:D
本题解析:石墨晶体中,每个碳原子与3个碳原子形成C—C,而在每个键中的贡献只有一半,所以C原子个数与C—C键数之比为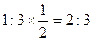
本题难度:简单
4、填空题 (11分) 铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
(1)钴原子的基态电子排布式为_____________________? _____________。
(2)金属铬的堆积方式属于A2型,其晶胞示意图为________(填序号)。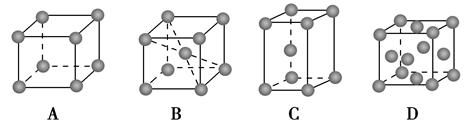

(3)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5 ℃,沸点117 ℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①固态CrO2Cl2属于______?__晶体;
②丙酮中碳原子采取的杂化方式为_?__;
③CS2属于____?_?___(填“极性”或“非极性”)分子。
(4)+3价铬的配合物K[Cr(C2O4)2(H2O)2]中,配体是________________,与C2O42—互为等电子体的分子是(填化学式)___?_____。
(5)CrCl3·6H2O(相对分子质量为266.5)有三种不同颜色的异构体:[Cr(H2O)6]Cl3、[Cr(H2O)5Cl]Cl2·H2O和[Cr(H2O)4Cl2]Cl·2H2O。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665 g CrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435 g。该异构体为_________?___________(填化学式)。
参考答案:(1)1s22s22p63s23p63d74s2或[Ar]3d74s2(2分)(2)B(1分)(3)①分子 (1分)②sp2杂化、sp3杂化 (各1分)③非极性 (1分)
(4)C2O42—、H2O N2O4?(各1分)(5)[Cr(H2O)4Cl2]Cl·2H2O(1分)
本题解析:(1)根据构造原理可形成钴原子的基态电子排布式。
(2)金属铬的堆积方式属于A2型,所以选项AD不正确。选项C不是立方体,错误,所以选项B正确。
(3)丙酮(CH3COCH3)、CCl4、CS2等均属于非极性分子,根据相似相溶原理可判断,固态CrO2Cl2属于分子晶体。根据丙酮的结构简式可知,2个甲基上的碳原子是sp3杂化,羰基碳原子是sp2杂化。CS2中的碳原子是sp杂化,属于直线型结构,是非极性分子。
(3)提供孤对电子的是配体,所以该化合物中C2O42—和H2O是配体。原子数和电子数均相等的是等电子体,因此和C2O42—互为等电子体的分子是N2O4。
(4)氯化银沉淀是1.435g,物质的量是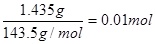 。2.665 g CrCl3·6H2O的物质的量是0.01mol,这说明分子中只有1个氯离子可以电离出,另外2个是配体,所以异构体是[Cr(H2O)4Cl2]Cl·2H2O。
。2.665 g CrCl3·6H2O的物质的量是0.01mol,这说明分子中只有1个氯离子可以电离出,另外2个是配体,所以异构体是[Cr(H2O)4Cl2]Cl·2H2O。
本题难度:一般
5、选择题 已知CsCl晶体的密度为ρg·cm-3,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为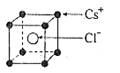
A.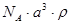
B.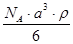
C.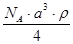
D.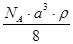
参考答案:A
本题解析:该立方体中含1个氯离子,Cs+个数=8×1/8=1,根据ρV=M/N知M=ρVNA=ρa3NA,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量是ρa3 NA,故选A.
本题难度:一般