时间:2017-07-10 19:40:53
1、选择题 X、Y两元素的质子数之和为22,X的原子核外电子数比Y少6个,下列说法中不正确的是(?)
A.Y的单质固态时是原子晶体
B.X的单质固态时为分子晶体
C.X与碳形成的化合物固态时为分子晶体
D.X与Y形成的化合物固态时为分子晶体
参考答案:D
本题解析:根据X、Y两元素的质子数之和为22,X的原子核外电子数比Y少6个可知X是氧元素,Y是硅元素。二氧化硅是原子晶体,D不正确。其余都是正确的,所以答案选D。
本题难度:简单
2、填空题 (6分)下列七种晶体:
A.二氧化硅
B.乙烷晶体
C.碳酸钠
D.氯化钠 E.晶体氩F.过氧化氢 G.镁(用字母填空)
(1)由原子直接构成的分子晶体是__________。
(2)含有非极性键的分子晶体是____________,含有离子键、共价键的化合物是___________。
(3)在一定条件下能导电且导电时未发生化学反应的是______________,受热熔化需克服共价键的是__________________,受热熔化后化学键不发生变化的是__________。
参考答案:(6分) (1)E? (2)BF? C? (3) G? A? BF(每空1分,不全对不给分)
本题解析:分子晶体有:B、E和F;原子晶体有:A;离子晶体包括C、D;金属晶体包括:G
(1)氩是单原子分子,分子之间由范德华作用力,选E
(2)乙烷CH3CH3中含有C—C非极性键,过氧化氢H2O2中含有O—O非极性键,均为分子晶体;
只要含有离子键,必属于离子离子晶体,碳酸钠阴离子中含有非金属原子之间的共价键,选C
(3)金属导电时不发生化学反应,故选镁符合条件
原子晶体受热熔化时需要克服共价键,选二氧化硅符合题意
受热熔化后化学键不发生变化的是分子晶体,故乙烷、过氧化氢符合题意
本题难度:简单
3、选择题 下列关于金属晶体的叙述正确的是( )
A.常温下,金属单质都以金属晶体形式存在
B.金属离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
C.钙的熔沸点低于钾
D.温度越高,金属的导电性越好
参考答案:B
本题解析:常温下,金属单质不都是以金属晶体形式存在的,例如汞在常温下呈液态,故A错误;金属离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失,故B正确,为本题的答案;钙的熔沸点高于钾,故C错误;温度越高,金属的导电性越差,故D错误。
点评:本题考查了金属晶体,该考点是高考常考的考点,本题难度不大,本题要记忆的是汞是一种比较特殊的金属,因为其在常温下呈现液体。
本题难度:一般
4、选择题 下列各组物质的晶体中,晶体类型相同的是
A.CO2和SiO2
B.CO2和H2O
C.NaCl和HCl
D.CCl4和KCl
参考答案:B
本题解析:A、CO2和SiO2前者属于分子晶体,后者属于原子晶体,类型不同,错误;B、CO2和H2O都是分子晶体,类型相同,正确;C、NaCl和HCl前者属于离子晶体,后者属于分子晶体,类型不同,错误;D、CCl4和KCl前者属于分子晶体,后者属于离子晶体,类型不同,错误,答案选B。
本题难度:一般
5、选择题 朱经武(Paul Chu)教授等发现钇钡铜氧化合物在90K时即具有超导性,该化合物的部分结构如图产所示: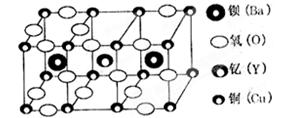
该化合物以Y2O3、BaCO3和CuO为原料,经研磨烧结而成,其原料配比(物质的量之比)为
A.1:1:1
B.1:4:6
C.1:2:3
D.2:2:3
参考答案:B
本题解析:略
本题难度:一般