时间:2017-07-10 19:39:46
1、填空题 (7分)(1)现有反应:C来源:91考试网 91eXAm.orgO(g)+H2O(g)? CO2(g)+H2(g)? △H>0。在850℃时,K=1。?此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,
CO2(g)+H2(g)? △H>0。在850℃时,K=1。?此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,
1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述反应向? ?方向进行。?
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是? ?。
③在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a? b(填“大于”“小于”或“等于”)。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,它的Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为?。
参考答案:(7分,除标注外每空2分)?
(1)①逆反应(1分)?②0 ≤ x<3.0?③小于?(2)5.6×10—5mo1/L
本题解析:略
本题难度:一般
2、选择题 自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析一定正确的是
[? ]
A.Ksp(PbS)<Ksp(CuS)
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
参考答案:D
本题解析:
本题难度:一般
3、填空题 (8分)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 。
(2)要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。
参考答案:(1)5?(2)6
本题解析:考查溶度积常数和pH的有关计算。
(1)根据氢氧化铜的溶度积常数表达式可知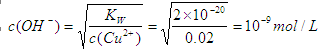 ,所以氢离子浓度为10-5mol/L,因此pH等于5。
,所以氢离子浓度为10-5mol/L,因此pH等于5。
(2)Cu2+浓度降至原来的千分之一后,铜离子的浓度变为2×10-4mol/L,所以根据氢氧化铜的溶
度积常数表达式可知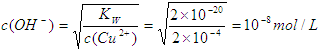
所以氢离子浓度为10-6mol/L,因此pH等于6。
本题难度:简单
4、填空题 草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)40?℃时混合一定体积的0.1?mol/L?H2C2O4溶液与一定体积0.01?mol/L酸性KMnO4溶液,填写表中空格。 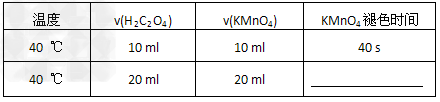
(2)用甲基橙作指示剂,通过酸碱滴定可测定草酸溶液浓度。甲基橙是一种常用的酸碱指示剂,甲基橙(用化学式HIn表示)本身就是一种有机弱酸,其电离方程式为:HIn H++In-。则酸根离子In-的颜色是_____________。甲基橙的酸性与草酸相比,__________(填前者强、前者弱、十分接近、无法判断)。
H++In-。则酸根离子In-的颜色是_____________。甲基橙的酸性与草酸相比,__________(填前者强、前者弱、十分接近、无法判断)。
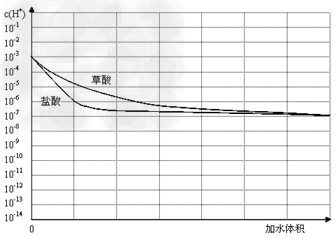
(3)常温下有pH均为3的盐酸和草酸溶液各10?ml,加水稀释,在上图中画出稀释过程中两种溶液中c(H+)变化的示意图并作必要的标注。
(4)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5?mol/L时可认为该离子已沉淀完全。现为了沉淀1?L0.01?mol/LMgCl2溶液中的Mg2+,加入100?mL0.1?mol/L的
(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全。
(5)(NH4)2C2O4溶液因NH4+水解程度稍大于C2O42-而略显酸性,0.1?mol/L(NH4)2C2O4溶液pH值6.4。现有某未知溶液,常温下由水电离出的c(H+)=1.0×10-5?mol/L,该溶液pH可能是_________(填字母)。
A.5 ?B.6 ?C.7? ?D.9
参考答案:(1)40s?
(2)黄色;前者弱
(3)?  (4)MgCl2与(NH4)2C2O4恰好完全反应,但有MgC2O4(s)
(4)MgCl2与(NH4)2C2O4恰好完全反应,但有MgC2O4(s) Mg2+(aq)+C2O42-(aq),
Mg2+(aq)+C2O42-(aq),
c(Mg2+)·c(C2O42-)=Ksp=8.1×10-5,而c(Mg2+)=c(C2O42-),c(Mg2+)=(8.1×10-5)-1/2 =9×10-3?mol/L>10-5?mol/L 故Mg2+未沉淀完全
(5)ABCD
本题解析:
本题难度:一般
5、计算题 (16分) (1)将2mol SO2和1mol O2放入2L密闭容器中发生如下反应:
2SO2+O2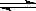 2SO3△H<0
2SO3△H<0
当达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,如下图表示: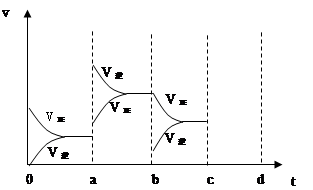 ?
?
(1)a b过程中改变的条件可能是? ?;
(2)b c过程中改变的条件可能是?;
(3)若增大压强时,反应速度变化情况画在c~d处;
(4) 达到第一个平衡时,测得平衡时SO3的浓度为0.5mol/L。请计算此条件下的平衡常数和SO2的转化率。(要求写出解题过程)
参考答案:(共16分)
(1)升温; (2)减小 SO3浓度;
(3) 如图(各2分,)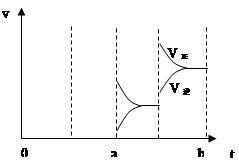
(4)? 4;? 50% (共10分)
本题解析:将2mol SO2和1mol O2放入2L密闭容器中发生如下反应:
2SO2+O2 2SO3△H<0
2SO3△H<0
a—b的变化,可以看到,正逆反应速率都发生了突跃,而且,逆反应速率大于正反应速率,由于该反应放热,所以ab的条件改变是升温,b—c的变化,逆反应速率突跃下降,正反应速率连续降低,改变的条件可能是减小 SO3浓度;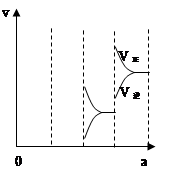
若增大压强时,反应速度变化情况如上图:
达到第一个平衡时,测得平衡时SO3的浓度为0.5mol/L。
2SO2?+? O2? ?2SO3△H<0
?2SO3△H<0
起始浓度? 1? 0.5? 0?
变化浓度? 0.5? 0.25? 0.5
平衡浓度? 0.5? 0.25? 0.5
此条件下的平衡常数K=C2(SO3)/C2(SO2)*C(O2)? =4。
SO2的转化率=0.5/1=50%。
点评:化学平衡常数,是指在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。平衡常数一般有浓度平衡常数和压强平衡常数。
在书写平衡常数表达式时,要注意以下问题:
① 在应用平衡常数表达式时,稀溶液中的水分子浓度可不写。因为稀溶液的密度接近于1 g/mL。水的物质的量浓度为55.6 mol/L。在化学变化过程中,水量的改变对水的浓度变化影响极小,所以水的浓度是一个常数,此常数可归并到平衡常数中去。
对于非水溶液中的反应,溶剂的浓度同样是常数。
② 当反应中有固体物质参加时,分子间的碰撞只能在固体表面进行,固体的物质的量浓度对反应速率和平衡没有影响,因此,固体的“浓度”作为常数,在平衡常数表达式中,就不写固体的浓度。
③ 化学平衡常数表达式与化学方程式的书写方式有关。同一个化学反应,由于书写的方式不同,各反应物、生成物的化学计量数不同,平衡常数就不同。但是这些平衡常数可以相互换算。
④ 不同的化学平衡体系,其平衡常数不一样。平衡常数大,说明生成物的平衡浓度较大,反应物的平衡浓度相对较小,即表明反应进行得较完全。因此,平衡常数的大小可以表示反应进行的程度。
⑤一般认为K>10^5反应较完全(即不可逆反应),K<10^(-5)反应很难进行(即不反应)。
平衡常数的数值大小可以判断反应进行的程度。
本题难度:一般