时间:2017-07-10 18:43:13
1、选择题 下列有关电解质的电离和水解说法正确的是(?)
A.在25℃时,任何水溶液中Kw=1×10-14。
B.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-)
C.在pH=2的盐酸酸化的FeCl3溶液,稀释至10倍,则溶液pH=3
D.0.1mol/L醋酸溶液中加入冰醋酸,平衡正向移动,醋酸的电离程度增大
参考答案:B
本题解析:A.在25℃时,在任何物质的稀的水溶液中存在着Kw=1×10-14。如果浓度较大,就不符合。错误。B.在溶液中H+由H2O和NaHSO4共同电离产生。NaHSO4=Na++H++ SO42-.;H2O H++OH-.故c(H+)=c(OH-)+c(SO42-)。正确。C.在pH=2的盐酸酸化的FeCl3溶液,若稀释至10倍,若盐水解的程度不变则溶液pH=3,但稀释使FeCl3的水解程度增大故溶液2<pH<3.错误。D.0.1mol/L醋酸溶液中加入冰醋酸,平衡正向移动,但是增加的醋酸比平衡移动减少的醋酸要多,该醋酸的电离程度反而减小。错误。
H++OH-.故c(H+)=c(OH-)+c(SO42-)。正确。C.在pH=2的盐酸酸化的FeCl3溶液,若稀释至10倍,若盐水解的程度不变则溶液pH=3,但稀释使FeCl3的水解程度增大故溶液2<pH<3.错误。D.0.1mol/L醋酸溶液中加入冰醋酸,平衡正向移动,但是增加的醋酸比平衡移动减少的醋酸要多,该醋酸的电离程度反而减小。错误。
本题难度:一般
2、选择题 下列关于0.10 mol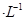 NaHSO3溶液的说法正确的是
NaHSO3溶液的说法正确的是
A.加入NaOH固体,溶液pH减小
B.温度升高,c(HSO3-)增大
C.25 C时,加水稀释后,n(H+)与n(OH-)的乘积变大
C时,加水稀释后,n(H+)与n(OH-)的乘积变大
D.NaHSO3的电离方程式为NaHSO3 = Na++H++SO32-
参考答案:C
本题解析:根据NaHSO3+NaOH=Na2SO3+H2O,加入NaOH固体,溶液PH增大,A项错误;HSO3-的电离过程和水解过程都是吸热过程,温度升高,电离过程增大,水解程度增大,c(HSO3-)减小,B项错误;在同一溶液中,n(H+)?n(OH-)=C(H+)?c(OH-)V×V=KwV×V,加水稀释,KW不变,V增大,则加水稀释后,n(H+)与n(OH-)的乘积变大,C项正确;钠盐是强电解质,电离方程式为NaHSO3 = Na++HSO3-,D项错误;选C。
考点:考查NaHSO3溶液中各种关系。
本题难度:一般
3、选择题 已知室温时,0.1mo1/LCH3COOH在水中有0.1%发生电离,下列叙述正确的是( )
A.该溶液的pH=5
B.升高温度,溶液的pH增大
C.CH3COOH的电离平衡常数约为1×10-6
D.由CH3COOH电离出的c(H+)约为水电离出的c(H+)的106倍
参考答案:A.HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,则pH=-lg(10-4)=4,故A错误;
B.温度升高促进弱酸的电离,氢离子浓度变大,则pH变小,故B错误;
C.由HA═H++Ac-,c(H+)=c(Ac-)=10-4mol/L,则电离平衡常数为=[H+][Ac-]HAc=10-4×10-40.1=1×10-7,故C错误;
D.HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,水电离产生的氢离子浓度为10-10mol/L,则由HA电离出的c(H+)约为水电离出的c(H+)的106倍,故D正确;
故选D.
本题解析:
本题难度:简单
4、选择题 醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是(?)
H++CH3COO-,下列叙述不正确的是(?)
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
参考答案:B
本题解析:A.在醋酸溶液中存在的阳离子是H+、阴离子是OH-和CH3COO-。根据电荷守恒可知,醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)。正确。B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(H+)减小。由于在溶液中存在Kw=c(H+)·c(OH-).所以c(OH-)增大。错误。C. 醋酸溶液中存在电离平衡CH3COOH H++CH3COO-加少量的CH3COONa固体,c(CH3COO-)增大。根据平衡移动原理,增大生成物的浓度,平衡向逆向移动。正确。D.由于CH3COOH是弱酸,部分电离,而NaOH是强碱,完全电离。在常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液电离产生的c(H+)=c(OH-)=10—2mol/L.等体积混合后,电离的H+恰好完全被中和,这时破坏了醋酸的电离平衡,醋酸会继续电离产生H+和CH3COO-直至达到新的平衡,由于此时溶液的c(H+)>c(OH-),所以pH<7。正确。
H++CH3COO-加少量的CH3COONa固体,c(CH3COO-)增大。根据平衡移动原理,增大生成物的浓度,平衡向逆向移动。正确。D.由于CH3COOH是弱酸,部分电离,而NaOH是强碱,完全电离。在常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液电离产生的c(H+)=c(OH-)=10—2mol/L.等体积混合后,电离的H+恰好完全被中和,这时破坏了醋酸的电离平衡,醋酸会继续电离产生H+和CH3COO-直至达到新的平衡,由于此时溶液的c(H+)>c(OH-),所以pH<7。正确。
本题难度:一般
5、填空题 (12分)Ⅰ、现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________;
(2)丙溶液中存在电离平衡为______________________(用电离平衡方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为_________;
Ⅱ、某一元弱酸(用HA表示)在水中的电离方程式是HA
参考答案:
本题解析:
本题难度:一般