时间:2017-07-10 18:43:13
1、选择题 有五瓶溶液分别是:①10 mL 0.6 mol·L-1 NaOH水溶液,②20 mL 0.5 mol·L-1 H2SO4水溶液,③30 mL0.4 mol·L-1 HCl水溶液,④40 mL 0.3 mol·L-1 醋酸水溶液,⑤50 mL 0.2 mol·L-1 蔗糖水溶液,以上各瓶溶液所含离子、分子总数的大小顺序是
[? ]
A.①>②>③>④>⑤
B.②>①>③>④>⑤
C.⑤>④>③>②>①
D.②>③>④>①>⑤
参考答案:C
本题解析:
本题难度:一般
2、选择题 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示,下列说法正确的是 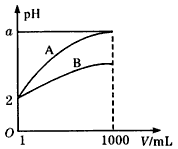
[? ]
①A、B两酸溶液的物质的量浓度一定相等 ②稀释后,A酸溶液的酸性比B酸溶液强
③a=5时,A是强酸,B是弱酸 ④若A、B都是弱酸,则5>a>2
A.②④
B.③④
C.①③
D.④
参考答案:B
本题解析:
本题难度:一般
3、填空题 (6分)A、B两种物质都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合,要求A1 溶液中的水的电离程度小于A2 溶液中水的电离程度;B1 溶液中的水的电离程度小于B2溶液中水的电离程度;
(1)请写出下列各物质的化学式:
A1 A2 B1 B2
(2)B1溶液中的水的电离程度小于B2溶液中水的电离程度,其原因是:
___________________________________________________________________
参考答案:(1)A1 NaOH A2 NaNO2 B1 HNO3 B2 NH4NO3 (每空1分)
(2)B1电离出的H+抑制水的电离,B2电离出的NH4+促进水的电离(2分)
本题解析:A1 溶液中的水的电离程度小于A2 溶液中水的电离程度,说明A1是碱,A2是盐水解显碱性。B1 溶液中的水的电离程度小于B2溶液中水的电离程度,同样可知B1是酸,B2是盐水解显酸性。所以正确的组合是A1 NaOH A2 NaNO2 B1 HNO3 B2 NH4NO3。
本题难度:一般
4、填空题 盐酸和醋酸是生产、生活和化学实验中常用的酸。请回答:
(1)人的胃液中含有盐酸,经测定某人胃液的pH=2,则其中的c(H+)=______mol/L。
(2)食醋常用于食品调味,其主要成分为醋酸。醋酸的电离方程式为:____________。
(3)室温下,pH=3的盐酸和醋酸溶液,下列各项中相等的是_______(填序号)。
① 溶液中c(H+) ② 酸的物质的量浓度 ③ 完全中和时,消耗NaOH的质量
(4)实验室配制氯化铁溶液时,加入少量盐酸的作用是______________。
参考答案:(1)0.01
(2)CH3COOH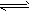 CH3COO-+H+
CH3COO-+H+
(3)①
(4)抑制Fe3+水解
本题解析:
本题难度:一般
5、选择题 在下列条件下,能大量共存的微粒组是
| 化学式 | CH3COOH | HClO | H2CO3 |
| 电离常数(25℃) | Ki =1.7×10-5 | Ki =3.0×10-8 | Ki1=4.3×10-7;Ki2=5.6×10-11 |
参考答案:A
本题解析: A.c(H+)=1×10-14mol/L的溶液是碱性溶液,在此溶液中K+、Na+、AlO2-、S2O32-不会发生任何反应,可以大量共存,正确;B. 根据上表提供的数据可知酸性:HClO>HCO3-,所以HClO、CO32-会发生反应而不能大量共存,错误;C.能与Al反应生成H2的溶液可能是酸性溶液,也可能是碱性溶液,在酸性溶液中H+和NO3-、I-会发生氧化还原反应而不能大量共存;在碱性溶液中NH4+不能大量存在,错误;D.中性的溶液中:CO32-、AlO2-会发生反应而不能大量存在,错误。
考点:考查离子大量共存的知识。
本题难度:一般