时间:2017-07-10 18:43:13
1、选择题
A.醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.醋酸与锌反应速率大
D.盐酸和醋酸分别与锌反应的速率一样大
参考答案:BC
本题解析:pH相同的盐酸和醋酸都稀释2倍,盐酸中c(H+)变为原来的一半,而醋酸是弱酸,稀释后,电离程度增大,c(H+)比稀释前小,但大于原来浓度的一半,即比盐酸溶液中H+的浓度大,锌与醋酸的反应速率快;酸和锌的量都是已知的,首先进行过量判断,经计算锌的量不足,所以两种溶液放出H2的量是相等的。
本题难度:简单
2、选择题 一定温度下,用水稀释c mol·L-1的稀醋酸,若用Kw表示水的离子积,则下列数值随水量的增加而增大的是
A.c(H+)/c(OH-)
B.c(CH3COOH)/c(H+)
C.c(CH3COO-)/c(CH3COOH)
D.c(H+)/KW
参考答案:C
本题解析:用水稀释稀醋酸过程中,醋酸电离平衡向电离的方向移动,醋酸的电离度增大,酸性减弱,水的电离平衡向电离的方向移动,A、c(H+)/c(OH-) 减小;B、c(CH3COOH)/c(H+)减小; C、c(CH3COO-)/c(CH3COOH) 增大;D、c(H+)/KW减小。答案选C。
考点:弱电解质的电离平衡
本题难度:一般
3、选择题 下列各项所述内容对应的图像不正确的是
[? ]
A.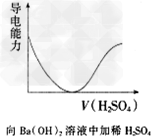
B.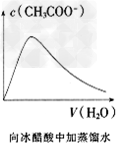
C.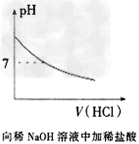
D.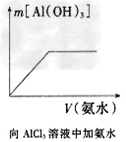
参考答案:C
本题解析:
本题难度:一般
4、填空题 在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答: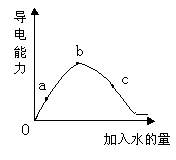
⑴“O”点导电能力为0的理由是:?。
⑵a、b、c三点溶液中,[H+]由小到大的顺序是:?。
⑶a、b、c三点溶液中,醋酸的电离程度最大的是:?。
⑷若使c点溶液中[CH3COO-]增大,而[H+]减小,可采取的措施主要有:①?;②?;③?;④?。
参考答案:⑴冰醋酸未电离,其中没有自由移动的离子;⑵c<a<b;⑶c;⑷①CH3COOH;②NaOH;③Na2CO3;④Mg。
本题解析:⑴冰醋酸未电离,其中没有自由移动的离子;⑵导电能力越强,自由移动的离子浓度越大,故[H+]由小到大的顺序是c<a<b;⑶随着加水的量的增加,将促进醋酸的电离,故c点醋酸的电离程度最大;⑷使醋酸溶液中的CH3COO-溶液增大,可加入物质与H+反应使醋酸电离平衡向电离的方向移动,如氢氧化钠、碳酸钠及金属镁;而加入醋酸钠,虽使醋酸电离平衡向左移动,但剩余的CH3COO-的浓度仍是增加的,所以加入醋酸钠也符合题意。
本题难度:一般
5、选择题 物质的量浓度相同的下列各溶液,由水电离出的氢氧根浓度由大到小的顺序是( )
①NaHSO4②NaHCO3③Na2CO3④Na2SO4.
A.④③②①
B.①②③④
C.③②④①
D.③④②①
参考答案:A、NaHSO4是强电解质,能完全电离出氢离子,显示强酸性,对水的电离抑制程度最大,故由水电离出的氢氧根浓度最小;
NaHCO3和Na2CO3都是能水解的盐,对水的电离起到促进的作用,碳酸钠中碳酸根的水解程度大于碳酸氢钠中碳酸氢根离子的水解程度,所以碳酸钠对水的电离起到的促进作用大,由水电离出的氢氧根浓度是碳酸钠大于碳酸氢钠,硫酸钠不水解,对水的电离程度无影响,
综上由水电离出的氢氧根浓度由大到小的顺序是③②④①,
故选C.
本题解析:
本题难度:一般