时间:2017-07-10 18:32:00
1、计算题 某温度下,纯水中c(H+)=1.0×10-6 mol·L-1,则此时c(OH-)=? ▲?mol·L-1。
在此温度下,将100 mL pH=1的稀硫酸和盐酸的混合液与100 mL未知浓度的Ba (OH)2溶液相混合,充分反应后过滤,得0.233g沉淀,滤液的pH值变为11(设混合液体积为两者之和,所得固体体积忽略不计)。
则原混合酸液中SO42-的物质的量=? ▲?mol。
Cl-的物质的量=? ▲?mol。
Ba(OH)2的物质的量浓度=? ▲?mol·L-1 。
参考答案:1.0×10-6?(2分);? 0.001(2分);? 0.008(2分);? 0.15(2分)
本题解析:略
本题难度:简单
2、选择题 对于常温下0.0lmol/L的氨水,下列叙述正确的是
A.c(H+)+c(NH4+)=c(OH-)
B.与等体积等浓度的氯化铵溶液混合c(NH4+)+c(NH3· H2O)="0.02" mol·L-1
C.与等体积等浓度的盐酸混合后所得溶液显酸性
D.由H2O电离出的c(H+)=1.0×10-12 mol·L-1
参考答案:AC
本题解析:氨水中只有一水合氨和水是电解质,分别能部分电离出铵根离子、氢离子和氢氧根离子三种离子,根据溶液呈电中性或电荷守恒原理,则溶液中c(OH-)=c(NH4+)+c(H+),正确;设溶液的体积均为1L,由于n=c?V,则混合前一水合氨和氯化铵的物质的量都是0.01mol,n(NH4+)+n(NH3·H2O)=0.01mol+0.01mol=0.02mol,两种稀溶液的密度都接近于水,则混合前后可以忽略溶液体积的变化,则混合后溶液的体积为2L,根据物料守恒原理可知,混合溶液中n(NH4+)+n(NH3·H2O)=0.02mol,由于c=n/V,因此混合后溶液中c(NH4+)+c(NH3·H2O)=0.02mol/2L=0.01mol/L,故B错误;设溶液的体积均为1L,由于n=c?V,混合前一水合氨和HCl的物质的量相等,则混合时二者恰好完全中和,得到氯化铵和水,NH4Cl是强酸弱碱盐,其完全电离出铵根离子能部分水解,导致氯化铵溶液显酸性,故C正确;依题意,常温下c(NH3·H2O)=0.01mol/L,NH3·H2O是弱碱或弱电解质,则其电离出的c(OH-)<0.01mol/L,由于水的电离程度远小于一水合氨,则溶液中的c(OH-)<0.01mol/L,常温下Kw=1.0×10-14,则溶液中c(H+)=Kw/c(OH-)>1.0×10-12 mol·L-1,由于溶液中的氢离子来自水的电离,一水合氨不能电离出氢离子,则水电离出的c(H+)=溶液中c(H+)=>1.0×10-12 mol·L-1,故D错误。
本题难度:简单
3、选择题 判断溶液的酸碱性有多种方法。下列溶液中,一定呈碱性的是
A.能够使甲基橙呈现黄色
B.溶液的pH>7
C.溶液中:c(H+)<c(OH-)
D.溶液中:c(H+)>1×10-7mol·L
参考答案:C
本题解析:A项甲基橙的变色范围是pH<3.1的变红,pH>4.4的变黄,所以能够使甲基橙呈现黄色的溶液不一定显碱性;B项,只有在室温下溶液的pH>7,溶液显碱性;C项,溶液中:c(H+)<c(OH-)溶液肯定显碱性;D项,不同温度下,溶液的离子积可能大于1×10-14mol·L所以溶液中:c(H+)>1×10-7mol·L时,溶液不一定呈碱性。
本题难度:简单
4、填空题 (14分)
(1)纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)= ;
若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)= 。
(2)在CH3COONa的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)明矾的水溶液显酸性,其原因是(用离子方程式表示) 。
(4)在25℃、101kPa下,0.5mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 。
(5)1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为 。
(6)已知:①N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol ;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4与NO2与完全反应生成氮气和气态水的热化学方程式为 。
参考答案:(1)5.0×10-7mol/L (2分) 5.0×10-11mol/L(2分)
(2)c( Na+) > c(CH3COO-) > c( OH-)> c(H+)(2分),
(3)Al3+ + 3H2O  Al(OH)3 + 3H+(2分) Al(OH)3;
Al(OH)3 + 3H+(2分) Al(OH)3;
(4)CH3OH (l)+ O2 (g) =CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1
O2 (g) =CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1
(5)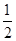 H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=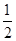 Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(2分)
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(2分)
(6)2 N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1 (2分)
或写成2N2H4 (g) + NO2 (g) = N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1
N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1
本题解析:(1)在纯水中存在电离平衡:H2O H++OH-,纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)=5.0×10-7mol/L. Kw=2.5×10-13;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)=Kw÷c(H+)=2.5×10-13÷5.0×10-3=5.0×10-11mol/L;(2)在CH3COONa的溶液中,由于CH3COO-水解消耗,所以c( Na+) > c(CH3COO-);水解消耗水电离产生的H+,破坏了水的电离平衡,最终使溶液中的OH-的浓度大于H+的浓度,c( OH-)> c(H+)。但是盐的水解程度是微弱的,盐电离产生的离子浓度远大于水电离产生的离子的浓度,所以c(CH3COO-) > c( OH-) c(H+)。故各离子的物质的量浓度由大到小的顺序是c( Na+) > c(CH3COO-) > c( OH-)> c(H+);(3)明矾的水溶液显酸性,其原因是Al3+ + 3H2O
H++OH-,纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)=5.0×10-7mol/L. Kw=2.5×10-13;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)=Kw÷c(H+)=2.5×10-13÷5.0×10-3=5.0×10-11mol/L;(2)在CH3COONa的溶液中,由于CH3COO-水解消耗,所以c( Na+) > c(CH3COO-);水解消耗水电离产生的H+,破坏了水的电离平衡,最终使溶液中的OH-的浓度大于H+的浓度,c( OH-)> c(H+)。但是盐的水解程度是微弱的,盐电离产生的离子浓度远大于水电离产生的离子的浓度,所以c(CH3COO-) > c( OH-) c(H+)。故各离子的物质的量浓度由大到小的顺序是c( Na+) > c(CH3COO-) > c( OH-)> c(H+);(3)明矾的水溶液显酸性,其原因是Al3+ + 3H2O  Al(OH)3 + 3H+;(4)燃烧热是1mol的可燃物完全燃烧产生稳定的氧化物时所放出的热量,根据题意可得甲醇燃烧热的热化学方程式为CH3OH (l)+
Al(OH)3 + 3H+;(4)燃烧热是1mol的可燃物完全燃烧产生稳定的氧化物时所放出的热量,根据题意可得甲醇燃烧热的热化学方程式为CH3OH (l)+ O2 (g)=CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1;(5)中和热是酸碱发生中和反应产生1mol的水时所放出的热量,由于1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为
O2 (g)=CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1;(5)中和热是酸碱发生中和反应产生1mol的水时所放出的热量,由于1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为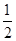 H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=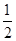 Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;(6)②×2-①,整理可得2 N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1或写为2N2H4 (g) + NO2 (g) =
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;(6)②×2-①,整理可得2 N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1或写为2N2H4 (g) + NO2 (g) = N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1。
N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1。
考点:考查弱电解质的电离、水的离子积常数、盐的水解、盖斯定律的应用、离子浓度比较、中和热、燃烧热的热化学方程式的书写的知识。
本题难度:一般
5、选择题 将1mL pH值相同的醋酸和盐酸,分别用蒸馏水稀释到l00 mL,稀释后两溶液的pH 分别为m和n ?(?)
A m>n?B m=n? C m<n? D 不能确定
参考答案:C
本题解析:分别用蒸馏水稀释后,由于醋酸是弱酸,存在电离平衡,盐酸是强酸,全部电离,所以,醋酸中氢离子的浓度大于盐酸中氢离子的浓度,m<n ,选C。
本题难度:简单