时间:2017-07-10 18:32:00
1、选择题 以0.1000 mol·L-1 NaOH溶液滴定c mol·L-1,某弱酸HA溶液,其滴定曲线如图所示,下列说法正确的是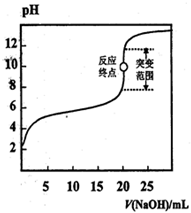
A.可用甲基橙作滴定指示剂
B.指示剂指示的滴定终点就是反应终点
C.突变范围的大小与酸的强弱及酸的浓度有关
D.滴定时氢氧化钠溶液盛放在带活塞的滴定管中
参考答案:C
本题解析:A、强碱与弱酸完全反应生成强碱弱酸盐,水解显碱性,故应选用碱性条件下变色的指示剂,如酚酞,而不可选甲基橙,错误;B、反应终点是指酸与碱刚好完全反应,而指示剂指示的是一个变色范围,错误;C、当酸的酸性很强,浓度较稀时,突变范围就大,正确;D、带活塞的为酸式滴定管,不可以盛NaOH溶液,错误。
本题难度:简单
2、填空题 某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下: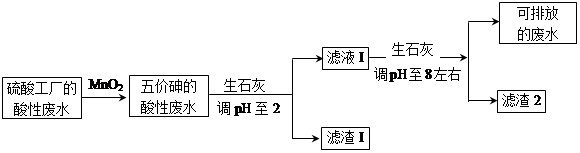
相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4g/L | 1.6g·L-1 |
| 排放标准 | pH 6~9 | 0.5mg·L-1 |
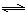 HAsO42-+OH-,该步水解的平衡常数(25℃)为:?(保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为:?(保留两位有效数字)。参考答案:(17分)
(1)0.3 (2分)
(2)5.7×10-17(2分)
(3)2H++MnO2+H3AsO3==H3AsO4+Mn2++H2O (3分)
(4)①CaSO4(2分)
②H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO43-)增大,Ca3(AsO4)2开始沉淀(3分)[或:pH增大,促进H3AsO4电离,c(AsO43-)增大,Qc=c3(Ca2+)·c2(AsO43-)≥Ksp[Ca3(AsO4)2,Ca3(AsO4)2才沉淀]
③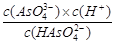 ?(2分)? 2.5×10-3(3分)
?(2分)? 2.5×10-3(3分)
本题解析:(1)读表2中信息,以1L废水为研究对象,其中含有29.4gH2SO4,由于硫酸的相对分子质量为98,m/M=n,则n(H2SO4)=29.4g÷98g/mol=0.3mol,由于c=n/V,则c(H2SO4)=0.3mol÷1L=0.3mol/L;(2)FeAsO4是难溶盐,废水中存在其沉淀溶解平衡:FeAsO4 (s) Fe3++AsO43-,则Ksp(FeAsO4)=c(Fe3+)?c(AsO43-),所以c(AsO43-)= Ksp(FeAsO4)/c(Fe3+)=5.7×10-21/1.0×10-4 mol·L-1=5.7×10-17 mol·L-1;(3)H3AsO3失去2个电子被氧化为H3AsO4,MnO2得到2个电子被还原为Mn2+,废水是酸性溶液,根据电子、电荷、原子守恒原理可得:2H++MnO2+H3AsO3==H3AsO4+Mn2++H2O;(4)①由于CaO+2H+==Ca2++H2O,读表1中信息可知,加入生石灰调解pH到2时,增大钙离子浓度,使CaSO4 (s)
Fe3++AsO43-,则Ksp(FeAsO4)=c(Fe3+)?c(AsO43-),所以c(AsO43-)= Ksp(FeAsO4)/c(Fe3+)=5.7×10-21/1.0×10-4 mol·L-1=5.7×10-17 mol·L-1;(3)H3AsO3失去2个电子被氧化为H3AsO4,MnO2得到2个电子被还原为Mn2+,废水是酸性溶液,根据电子、电荷、原子守恒原理可得:2H++MnO2+H3AsO3==H3AsO4+Mn2++H2O;(4)①由于CaO+2H+==Ca2++H2O,读表1中信息可知,加入生石灰调解pH到2时,增大钙离子浓度,使CaSO4 (s) Ca2++SO42-的平衡向左移动,析出CaSO4沉淀[加入生石灰调解pH到2时,增大钙离子浓度,使Qc=c(Ca2+)·c(SO42-)≥Ksp[CaSO4),开始析出CaSO4沉淀];②H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO43-)增大,Ca3(AsO4)2 (s)
Ca2++SO42-的平衡向左移动,析出CaSO4沉淀[加入生石灰调解pH到2时,增大钙离子浓度,使Qc=c(Ca2+)·c(SO42-)≥Ksp[CaSO4),开始析出CaSO4沉淀];②H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO43-)增大,Ca3(AsO4)2 (s)  3Ca2++2AsO43-的平衡向左移动,开始析出Ca3(AsO4)2沉淀[或pH增大,促进H3AsO4电离,c(AsO43-)增大,Qc=c3(Ca2+)·c2(AsO43-)≥Ksp[Ca3(AsO4)2,Ca3(AsO4)2才沉淀];③多元弱酸分步电离,则H3AsO4
3Ca2++2AsO43-的平衡向左移动,开始析出Ca3(AsO4)2沉淀[或pH增大,促进H3AsO4电离,c(AsO43-)增大,Qc=c3(Ca2+)·c2(AsO43-)≥Ksp[Ca3(AsO4)2,Ca3(AsO4)2才沉淀];③多元弱酸分步电离,则H3AsO4 H++H2AsO4-、H2AsO4-
H++H2AsO4-、H2AsO4- H++HAsO42-、HAsO42-
H++HAsO42-、HAsO42- H++AsO43-,根据平衡常数定义式可得,第三步电离平衡常数K3="[" c(H+)? c(AsO43-)]/ c(HAsO42-);水的离子积常数Kw= c(H+)? c(OH-),AsO43-+H2O
H++AsO43-,根据平衡常数定义式可得,第三步电离平衡常数K3="[" c(H+)? c(AsO43-)]/ c(HAsO42-);水的离子积常数Kw= c(H+)? c(OH-),AsO43-+H2O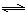 HAsO42-+OH-的平衡常数的计算表达式为[c(HAsO42-)?c(OH-)]/ c(AsO43-),分子、分母同时乘以c(H+),则水解平衡常数=[c(HAsO42-)?c(OH-)? c(H+)]/[ c(H+)?c(AsO43-)]= Kw/K3=(1.0×10-14)÷(4.0×10-12)=2.5×10-3。
HAsO42-+OH-的平衡常数的计算表达式为[c(HAsO42-)?c(OH-)]/ c(AsO43-),分子、分母同时乘以c(H+),则水解平衡常数=[c(HAsO42-)?c(OH-)? c(H+)]/[ c(H+)?c(AsO43-)]= Kw/K3=(1.0×10-14)÷(4.0×10-12)=2.5×10-3。
本题难度:困难
3、选择题 如何实现化石燃料的综合利用,减少化石燃料燃烧所造成的环境污染,是人类面临的重大挑战。下列关于化石燃料的说法不正确的是(?)
A.天然气除可用作清洁能源外,也可用于合成氨和生产甲醇等
B.煤的气化是指将固态煤粉碎成气态煤,以使煤燃烧时能与氧气充分接触而完全燃烧
C.石油分馏得到的汽油和石油催化裂化得到的汽油的成分和化学性质不相同
D.化石燃料也是重要的化工原料,乙烯和苯就是分别来自于石油和煤的基本化工原料
参考答案:B
本题解析:煤的气化是指将煤转化为可燃性气体的过程,是化学变化,选项C不正确,其余都是正确的,答案选B。
本题难度:简单
4、选择题 常温下某溶液中水电离出的C(H+) = 1×10-13 mol/L,则下列说法中正确的是
A.该溶液一定呈酸性
B.该溶液一定呈碱性
C.该溶液中一定有C(OH-) = 0.1mol/L
D.该溶液的pH值为1或13
参考答案:D
本题解析:常温下某溶液中水电离出的C(H+) = 1×10-13 mol/L,说明该溶液中水的电离是被抑制的,所以溶液可能显酸性,也可能显碱性,D正确。答案选D。
本题难度:一般
5、选择题 常温下,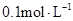 某一元酸
某一元酸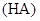 溶液中
溶液中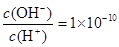 ,下列说法正确的是( )
,下列说法正确的是( )
A.溶液中由水电离出的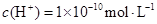
B.溶液中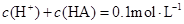
C.与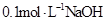 溶液等体积混合后所得溶液中
溶液等体积混合后所得溶液中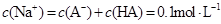
D.原溶液中加入一定量NaA晶体或加水稀释,溶液中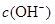 均增大
均增大
参考答案:D
本题解析:结合常温下水的离子积可计算出溶液中c(H+)=1×10—2mol/L,c(OH—)=1×10—12mol/L,可见酸HA为部分电离,属于弱酸
A:酸溶液中OH—全部由水电离产生,故水电离出c(H+)=1×10—12mol/L
B:由物料守恒可知c(HA)+c(A—)=0.1mol/L
C:两溶液混合后,体积增大一倍,故c(Na+)=c(HA)+c(A—)=0.05mol/L
D:电离平衡HA H++A—可知,加入NaA晶体时,A—浓度增大,平衡左移,c(H+)减小,c(OH—)增大;加水稀释,溶液酸性减弱,c(H+)减小,c(OH—)增大,故正确
H++A—可知,加入NaA晶体时,A—浓度增大,平衡左移,c(H+)减小,c(OH—)增大;加水稀释,溶液酸性减弱,c(H+)减小,c(OH—)增大,故正确
答案为D
本题难度:简单