实验操作?
现象
解释或结论
A.
在试管中的无色溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口?
试纸不变蓝
原溶液中无
NH4+
B.
向AgI沉淀中滴入稀KCl溶液?
有白色沉淀出现
Ksp(AgCl)?>Ksp(AgI)
C.
向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热
无红色沉淀生成
淀粉没有水解成葡萄糖
D.
pH均为1的盐酸、醋酸溶液分别用蒸馏水稀释m倍、n倍后测pH值
pH相同
m<n
参考答案:D
本题解析:
本题难度:一般
3、选择题 现有溶液中溶质的物质的量浓度均为0.01 mol·L-1的四种溶液:①盐酸,②硫酸,③醋酸,④NaOH,下列说法正确的是(?)
A.pH由小到大的顺序是①< ②< ③< ④
B.溶液中水电离出的H+浓度由小到大的顺序是②<①<④<③
C.取一定体积的④溶液,分别和①、②、③溶液完全中和,消耗①、②、③溶液的体积由小到大的顺序是②<①<③
D.取a体积的①溶液和b体积的④溶液混合后,溶液的pH为3,则a:b约为11:9
参考答案:D
本题解析:盐酸是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,氢氧化钠是一元强碱,所以在物质的量浓度相等的条件下,pH由小到大的顺序是②<①<③<④,A不正确;酸或碱溶液中氢离子或OH-浓度越大,对的水的电离程度抑制纯度越大,则溶液中水电离出的H+浓度由小到大的顺序是②<①=④<③,B不正确;C不正确,消耗三种酸的溶液体积由小到大的顺序是②<①=③;D中反应后盐酸是过量的,则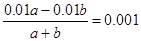 ,解得a:b=11:9,D正确,答案选D。
,解得a:b=11:9,D正确,答案选D。
点评:该题是中等难度的试题,试题贴近高考,紧扣教材。在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养。该题的关键是明确弱电解质的电离平衡特点以及pH计算的依据,然后结合题意灵活运用即可。
本题难度:一般
4、选择题 已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH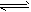 CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中
c(H+)/c(CH3COOH)值增大,可以采取的措施是
[? ]
A.加少量烧碱溶液
B.降低温度
C.加少量冰醋酸
D.加水
参考答案:D
本题解析:
本题难度:一般
5、选择题 某弱酸溶液中存在电离平衡HA?H++A-,下列叙述不正确的是( )
A.溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(A-)
B.0.10?mol/L的HA溶液中加水稀释,溶液中c(OH-)增大
C.HA溶液中加少量的NaA固体,平衡逆向移动
D.常温下,加入NaA固体可使HA的电离常数增大
参考答案:A.溶液呈电中性,阴阳离子所带电荷相等,根据电荷守恒得:c(H+)=c(OH-)+c(A-),故A正确;
B.加水稀释促进弱电解质电离,氢离子浓度减小,水的离子积常数不变,所以c(OH-)增大,故B正确;
C.加入NaA时,c(A-)增大,从而抑制弱酸电离,故C正确;
D.温度不变,弱酸的电离平衡常数不变,故D错误;
故选D.
本题解析:
本题难度:简单
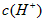 约为乙酸中
约为乙酸中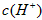 的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为a.乙酸.b,由此可知
的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为a.乙酸.b,由此可知