时间:2017-07-10 18:20:48
1、选择题 下列说法正确的是( )
A 化学键断裂过程中放出热量
B 化学键形成过程中需要吸收热量
C 在一个确定的化学反应中,反应物的总能量与生成物的总能量可能相等
D 化学反应除了生成新的物质外,还伴随着能量的变化
参考答案:D
本题解析:考查化学反应中能量变化的原因。从宏观的角度分析,若反应物的总能量高于生成物的总能量,则反应是放热反应,反之是吸热反应。从微观的角度分析,如果断键吸收的能量高于形成化学键所放出的能量,则反应是吸热反应,反之是放热反应。所以选项D是正确的。
本题难度:一般
2、选择题 2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l)若实验测得反应放出的热量为3695 kJ。则原混合气体中H2与CH4的物质的量之比是
A.1∶1
B.1∶3
C.1∶4
D.2∶3
参考答案:B
本题解析:
试题解析:H2与CH4的混合气体112L,n=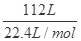 =5mol,设H2与CH4的物质的量分别为x、y,
=5mol,设H2与CH4的物质的量分别为x、y,
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ?mol-1,
2 571.6kJ
x 285.8x
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ?mol-1,
1 890kJ
y 890ykJ
则 ,解得x=1.25mol,y=3.75mol,原混合气体中H2与CH4的物质的量之比是1.25mol:3.75mol=1:3,故选B.
,解得x=1.25mol,y=3.75mol,原混合气体中H2与CH4的物质的量之比是1.25mol:3.75mol=1:3,故选B.
考点:有关反应热的计算
本题难度:一般
3、选择题 下列说法正确的是(?)
A.离子化合物中只能含有离子键
B.共价化合物中只能含有共价键
C.活泼金属元素和非金属元素之间一定以离子键结合
D.化学键不仅存在于原子之间,也存在于分子之间
参考答案:B
本题解析:A选项中离子化合物中除含有离子键之外,还可能含有共价键;B选项中共价化合物只存在共价键,没有离子键;C选项中活泼金属与非金属元素之间也可以以共价键结合,如AlCl3、BeCl2等;D选项中化学键只存在于原子之间或阴阳离子之间,分子之间的相互作用属于分子间作用力。
本题难度:简单
4、填空题 (12分)(1)用50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题: 
①烧杯间填满碎泡沫塑料的作用是 。
②若大烧杯上改为盖薄铁板,求得的反应热数值: (填“偏大”、“偏小”或“无影响”)
③若通过测定计算产生的热量为1.42kJ,请写该反应的热化学方程式: &#来源:91考试网 91ExAm.org160; 。
(2)①已知:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
则以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为: 。
②由气态基态原子形成1 mol化学键释放的最低能量叫键能。已知表中所列键能数据, 则
N2(g)+3H2(g) 2NH3(g) ΔH= kJ·mol-1。
2NH3(g) ΔH= kJ·mol-1。
| 化学键 | H—H | N—H | N≡N |
| 键能kJ·mol-1 | 436 | 391 | 945 |

参考答案:(1)①保温(或隔热、或减少热量损失) ②偏小
③HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-56.8kJ·mol-1
(2)①CH4(g)+2H2O(g)=== CO2(g)+ 4H2(g) ΔH=+165kJ·mol-1 ② -93 ③ -117
本题解析:(1)①中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;②大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会偏小;③由实验可知反应生成0.025moL水时,产生的热量为1.42kJ,则该反应的热化学方程式为HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-56.8kJ·mol-1;
(2)①根据盖斯定律,CH4(g)+2H2O(g)="==" CO2(g)+ 4H2(g)的ΔH=2×(+206.2 kJ·mol-1)-(+247.4 kJ·mol-1)=+165kJ·mol-1,所以CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:CH4(g)+2H2O(g)="==" CO2(g)+ 4H2(g) ΔH=+165kJ·mol-1;②根据ΔH=反应物的总键能-生成物的总键能,得N2(g)+3H2(g) 2NH3(g) ΔH=(945+3×436-2×3×391)kJ/mol=-93kJ/mol;③ClO-(aq)中的Cl元素的化合价是+1价,ClO-(aq)的能量是60,Cl-的化合价是-1价,能量是0,ClO3-中Cl的化合价是+5价,能量是63,根据ΔH=生成物的总能量-反应物的总能量得ΔH=63-3×60=-117kJ/mol。
2NH3(g) ΔH=(945+3×436-2×3×391)kJ/mol=-93kJ/mol;③ClO-(aq)中的Cl元素的化合价是+1价,ClO-(aq)的能量是60,Cl-的化合价是-1价,能量是0,ClO3-中Cl的化合价是+5价,能量是63,根据ΔH=生成物的总能量-反应物的总能量得ΔH=63-3×60=-117kJ/mol。
考点:考查中和热的测定,热化学方程式的书写,盖斯定律的应用。
本题难度:一般
5、选择题 下列用电子式表示化合物的形成过程正确的是(?)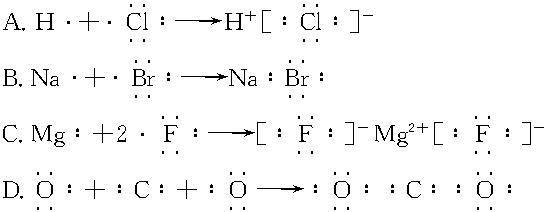
参考答案:C
本题解析:A项中生成的HCl是共价化合物;B项中生成的NaBr是离子化合物;D项中电子数有误。
本题难度:简单