时间:2017-07-10 18:13:20
1、选择题 已知4NH3(g)+5O2(g)?=?4NO(g)?+6H2O(l)?△H=-xkJ/mol。蒸发1mol?H2O(l)需要吸收的能量为44kJ,其它相关数据如下表
则表中z(用x、a、b、d表示)的大小为
[? ]
A.(x+4a+5b-6d-44)/4?
B.(x+12a+5b-12d-264)/4?
C.(x+4a+5b-6d-264)/4?
D.(x+12a+5b-12d-44)/4
参考答案:C
本题解析:
本题难度:一般
2、选择题 在常温常压下,已知:4Fe(s)+3O2(g)=2Fe2O3(s)△H1
4Al(s)+3O2(g)=2Al2O3(s)△H2
2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)△H3
则△H3与△H1和△H2间的关系正确的是( ? )
A.△H3=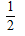 (△H1+△H2)
(△H1+△H2)
B.△H3=△H2-△H1
C.△H3=2(△H2+△H1)
D.△H3=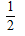 (△H2-△H1)
(△H2-△H1)
参考答案:D
本题解析:
本题难度:简单
3、填空题 1840年盖斯根据一系列实验事实得出规律,他指出:“若是一个反应可以分步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。”这是在各反应于相同条件下完成时的有关反应热的重要规律,称为盖斯定律。已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:
C(金刚石、s)+O2(g)=CO2(g);△H=-395.41kJ/mol,
C(石墨、s)+O2(g)=CO2(g);△H=-393.51kJ/mol,
则金刚石转化石墨时的热化学方程式为:__________________________。由此看来更稳定的碳的同素异形体为:____________。若取金刚石和石墨混合晶体共1mol 在O2中完全燃烧,产生热量为QkJ,则金刚石和石墨的物质的量之比为_____________(用含Q的代数式表示)。
参考答案:C(金刚石、s)=C(石墨、s) △H=-1.90kJ/mol;石墨;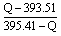
本题解析:
本题难度:一般
4、填空题 (Ⅰ)氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)以天然气为原料制H2是合成氨的一条重要的路线.甲烷的部分氧化,其反应式如下:
①CH4(g)+1/2O2?(g)=CO?(g)+2H2(g)△H1=-35.6kJ?molˉ1
试判断常温下,上述反应能否自发进行______(填“能”或“否”),有研究认为甲烷部分氧化的机理为:
②CH4(g)+2O2?(g)=CO?2(g)+2H2O(g)△H2=-890.3kJ?molˉ1
③CH4(g)+CO2?(g)=2CO?(g)+2H2(g)△H3=247.3kJ?molˉ1
试结合反应①,确定下面热化学反应方程式中的△H值
CH4(g)+H2O?(g)=CO?(g)+3H2(g)△H=______kJ?molˉ1
(2)恒温下,向一个2L的密闭容器中充入1mol?N2和2.6mol?H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 c(NH3)/(?mol?Lˉ1) 0.08 0.14 0.18 0.20 0.20 0.20 |




参考答案:(Ⅰ)、(1)反应CH4(g)+1/2O2?(g)=CO?(g)+2H2(g)的△H1=-35.6kJ?molˉ1<0.△S>0根据反应能否自发进行的判据:△H-T△S可推知该数值一定是小于0,故反应能自发进行,能,根据反应①②③,结合盖斯定律,可知反应CH4(g)+H2O?(g)=CO?(g)+3H2(g)△H=①×2-②×12250.3-③×12=250.3kJ?mol-1,故答案为:能;250.3;
(2)根据反应N2 +3H2 ?2NH3
初始浓度:0.5? 1.3? 0
变化浓度:0.1?0.3?0.2
平衡浓度:0.4?1.0?0.2
所以达到平衡时氮气的浓度是1.0mol/L,故答案为:1.0mol/L;
(3)在电解池中,阴极发生得电子的还原反应,在酸性介质下,氮气得电子的过程为:N2+6e-+6H+=2NH3,故答案为:N2+6e-+6H+=2NH3;
(4)用标准盐酸标定某氨水的浓度时,选择甲基橙能降低滴定误差,故答案为:A;
(Ⅱ)、(1)根据某温度下,H2CO3溶液的pC-pH关系图,可以得出pH=2~4时,H2CO3溶液中主要存在的离子为H+、HCO3-,故答案为:H+、HCO3-;?
(2)此温度下H2CO3?
H++HCO3-的电离平衡常数K=C(H+)?C(HCO3-)C(H2CO3)=10-6?mol/L,故答案为:10-6mol/L;
(3)氨水的电离能产生铵根离子,铵根离子水解能产生一水合氨分子,氨水和氯化铵的混和溶液能够抵抗外来少量酸碱的影响,保持自身pH变化不大,能形成缓冲溶液,故答案为:能.
本题解析:
本题难度:简单
5、选择题 下列说法正确的是
[? ]
A.氢镍碱性电池原理为H2+2NiO(OH)==2Ni(OH)2,则该电池负极反应式为:H2-2e-+2OH-==2H2O
B.热化学方程式中的计量系数既可以表示物质的量,也可以表示分子个数
C.已知1g氢气燃烧生成水蒸气放出120.9kJ的热,水蒸气分解的热化学方程式为:
2H2O(g)==2H2(g)+O2(g);△H=-483.6kJ/mol
D.已知S(s)+O2(g)=SO2(g);△H1 S(g)+O2(g)==SO2(g);△H2,则△H1<△H2
参考答案:A
本题解析:
本题难度:一般