时间:2017-07-10 17:34:58
1、填空题 (12分) Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
Q、R、X、Y、Z五种元素的原子序数依次递增。已知: ①Z的原子序数为29,其余的均为短周期主族元素;
①Z的原子序数为29,其余的均为短周期主族元素; ②Y原子价电子(外围电子)排布msnmpn?
②Y原子价电子(外围电子)排布msnmpn? ③R原子核外L层电子数为奇数;
③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子数分别为2和4。
④Q、X原子p轨道的电子数分别为2和4。 请回答下列问题:
请回答下列问题: (1)基态原子Z的电子排布式是?。
(1)基态原子Z的电子排布式是?。 (2)在[Z(NH3)4]2+离子中, NH3提供?。
(2)在[Z(NH3)4]2+离子中, NH3提供?。 (3)QX2的电子式?,一种由X和R组成的化合物与QX2互为等电子体,其化学式为?。
(3)QX2的电子式?,一种由X和R组成的化合物与QX2互为等电子体,其化学式为?。
(4) 比较X的氢化物与同主族相邻元素所形成的氢化物稳定性?,(填化学式),并说明理由?。
比较X的氢化物与同主族相邻元素所形成的氢化物稳定性?,(填化学式),并说明理由?。
参考答案:(1)? 1s22s22p63s23p63d104s1?。 (2)?孤电子对?。
(2)?孤电子对?。 (3)?
(3)?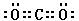 ?,? N2O?。
?,? N2O?。
(4) ? H2O>H2S?键长越短,键能越大,化合物越稳定?
? H2O>H2S?键长越短,键能越大,化合物越稳定?
本题解析:略
本题难度:一般
2、填空题 已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃就开始升华。
(1)氯化铝是____________(填“离子化合物”或“共价化合物”)。
(2)在500K和1.01×105Pa条件下,它的蒸气密度(换算成标准状况时)为11.92g/L,而且已知它的结构中有配位键,氯化铝的化学式为____,其结构式为_________。
(3)无水氯化铝在空气中强烈地“发烟”,其原因是_________________。
(4)设计一个可靠的实验,判别氯化铝是离子化合物还是共价化合物。你设计的实验是______________________。
参考答案:(1)共价化合物
(2)Al2Cl6;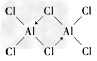
(3)氯化铝为强酸弱碱盐,与空气中的水发生水解反应产生HCl,HCl在空气中形成酸雾而“发烟”
(4)在一定条件下,将AlCl3加热至熔融,然后做导电实验,若不导电,则AlCl3为共价化合物
本题解析:
本题难度:一般
3、选择题 下列说法正确的是( )
A.短周期元素形成离子后,最外层均达8电子稳定结构
B.多电子原子中,在离核较近的区域运动的电子能量较低
C.非金属元素组成的化合物中只有共价键
D.HF、HCl、HBr、HI的热稳定性和还原性依次增强
参考答案:A.氢离子没有电子,不满足8电子稳定结构,故A错误;
B.离核较近的区域能量较低,能力越高的电子在离核远的区域运动,故B正确;
C.铵盐属于离子化合物,故C错误;
D.同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定,还原性越强,故HF、HCl、HBr、HI的热稳定性减弱,还原性依次增强,故D错误;
故选B.
本题解析:
本题难度:简单
4、选择题 下列说法中正确的是( )
A.在分子中,两个成键的原子间的距离叫键长
B.含有极性键的分子一定是极性分子
C.键能越大,表示该分子越容易受热分解
D.H-Cl的键能为431.8KJ?mol-1,H-I的键能为298.7KJ?mol-1,这可说明HCl分子比HI分子稳定
参考答案:A.键长是分子中两个成键原子的核间平均距离,不是两个成键的原子间的距离,故A错误;
B.CO2中有C、O元素之间形成极性键,且分子结构对称,正负电荷的中心重合,属于非极性分子,故B错误;
C.键能越大,表示该分子越稳定,受热难分解,故C错误;
D.H-Cl的键能大于H-I的键能,说明HCl分子比HI分子稳定,故D正确;
故选:D;
本题解析:
本题难度:一般
5、选择题 下列叙述中正确的是( )
A.阳离子一定含有金属元素,阴离子一定只含有非金属元素
B.某金属元素的阳离子和某非金属元素的阴离子组成的物质一定是纯净物
C.阴阳离子相互作用后一定形成离子化合物
D.金属钾不可能从盐的水溶液中置换出金属单质
参考答案:D
本题解析:
本题难度:简单