离子移动方向:OH-移向阴极
参考答案:A
本题解析:A 正确 强酸制弱酸,醋酸的酸性大于碳酸的酸性,所以,醋酸能溶解水垢,产生无色气泡。
B 错误 比较S、C的非金属性的强弱,应该比较最高价含氧酸的酸性强弱。
C 错误 二价铁的还原性大于溴离子的还原性,所以,氧化性: Fe3+> Br2
D 错误用石墨电极电解滴有酚酞的饱和NaCl溶液,阴极上氢离子放电生成氢气,此时氢氧根离子浓度增大,所以,溶液呈现红色,而不是氢氧根离子移向阴极。
本题难度:一般
2、选择题 下列实验设计方案中,可行的是
A.用碱石灰除去氯气中的水
B.在某试样中加入NaOH溶液,加热,产生能使石蕊试纸变红的气体即证明有NH4+
C.焰色反应实验中用硫酸清洗铁丝,灼烧后再沾取试样在酒精灯上灼烧观察
D.分液操作时 ,分液漏斗中下层液体从下口放出,上层液体从上口倒出 ,分液漏斗中下层液体从下口放出,上层液体从上口倒出
参考答案:D
本题解析:略
本题难度:简单
3、实验题 地下水中硝酸盐造成的氮污染已成为一个世界性的环节问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
(1)实验前:①先用0.1mol·L-1H2SO4洗涤Fe粉,其目的是____________________________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入__________________________(写化学式)。
(2)下图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式________________________________。t1时刻后,该反应仍在进行,溶液中NH的浓度在增大,Fe2+的浓度却没有增大,可能的原因是______________________________________。

(3)该课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
假设一:溶液的pH;
假设二:__________________________________________;
假设二:__________________________________________;
……
(4)请你设计实验验证上述假设一,写出实验步骤及结论。(已知:溶液中的NO3-浓度可用离子色谱仪测定)

参考答案:(1)去除铁粉表面的氧化物等杂质;N2
(2)4Fe+NO+10H+=2Fe+NH+3H2O;生成Fe的水解(或和溶液中的OH-结合)
(3)温度;铁粉颗粒大小
(4)
本题解析:
本题难度:一般
4、填空题 (12分)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:

步骤Ⅰ:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。
步骤Ⅱ:在暗处放置30min,并不时轻轻摇动。30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
① +IBr → +IBr →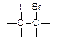
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
⑴已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应用?▲?,用方程式表示碘瓶必须干燥的原因?▲?。
⑵步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是?▲?。
⑶步骤Ⅲ中所加指示剂为?▲?,滴定终点的现象?▲?。
⑷反应结束后从液体混合物中回收四氯化碳,则所需操作有?▲?。
参考答案:⑴酸式滴定管(或移液管)? IBr+H2O=HIO+HBr
⑵碘瓶置于暗处可以减少IBr的挥发,不断摇动可以让物质间充分反应。
⑶淀粉溶液?溶液由蓝色恰好变为无色
⑷分液、蒸馏
本题解析:略
本题难度:一般
5、填空题 辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:

⑴写出浸取过程中Cu2S溶解的离子方程式:____________________。
⑵回收S过程中温度控制在50~60℃之间,不宜过高或过低的原因是_____________。
⑶气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为___________________________;向滤液M中加入(或通入)下列__________(填字母)物质,得到另一种可循环利用的物质。
a.铁? b.氯气? c.高锰酸钾?
⑷保温除铁过程中,加入CuO的目的是________________________;蒸发浓缩时,要用HNO3溶液调节溶液的pH,其理由是___________________________。
参考答案:(1)Cu2S+4Fe3+=2Cu2++4Fe2++S
(2)温度过高苯容易挥发,温度过低溶解速率小;
(3)4NOx+(5-2x)O2+2H2O= 4HNO3? b,(4)调节溶液的pH,使铁元素(Fe3+)完全转化为Fe(OH)3沉淀 抑制Cu2+的水解(不引入其他杂质)
本题解析:(1)Fe3+ 作氧化剂,Cu2S被氧化,离子议程式为:Cu2S+4Fe3+=2Cu2++4Fe2++S,答案:Cu2S+4Fe3+=2Cu2++4Fe2++S;(2)苯沸点比较低,温度过高苯容易挥发,从反应动力学来看,温度过低溶解速率小;答案:温度过高苯容易挥发,温度过低溶解速率小;(3)NOx作还原剂,根据质量守恒和电子得失写出方程式: 4NOx+(5-2x)O2+2H2O= 4HNO3;向滤液M中通入Cl2将FeCl2氧化成FeCl3,可循环使用,选b, 答案: 4NOx+(5-2x)O2+2H2O= 4HNO3;b;(4)Fe3++3H2O Fe(OH)3+3H+ ,加入CuO,使水解平衡正向进行,调节溶液的pH,使铁元素(Fe3+)完全转化为Fe(OH)3沉淀;加热过程中Cu2+ 会水解,加入硝酸抑制Cu2+的水解(不引入其他杂质);答案:调节溶液的pH,使铁元素(Fe3+)完全转化为Fe(OH)3沉淀?抑制Cu2+的水解(不引入其他杂质) Fe(OH)3+3H+ ,加入CuO,使水解平衡正向进行,调节溶液的pH,使铁元素(Fe3+)完全转化为Fe(OH)3沉淀;加热过程中Cu2+ 会水解,加入硝酸抑制Cu2+的水解(不引入其他杂质);答案:调节溶液的pH,使铁元素(Fe3+)完全转化为Fe(OH)3沉淀?抑制Cu2+的水解(不引入其他杂质)
本题难度:一般
|