时间:2017-03-05 16:05:09
1、实验题 硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。?
⑴某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
[观察外观] 该硫酸铵化肥无可见机械杂质。
[实验探究]按下图所示装置进行实验。
①烧瓶内发生反应的离子方程式为:___________________。烧杯中盛放的试剂最好是______(填“浓硫酸”、 “稀硫酸”或“水”)
②实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是____________。
[交流讨论]
③甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:____________;
④乙同学:实验装置中还存在另一个明显缺陷是:______________;经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
[探究结论]
⑤称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。则该化肥_________(填“是”或“不是”)一等品。 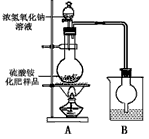
⑵某工厂用石膏、NH3、H2O、CO2制备(NH4)2SO4,首先石膏磨成粉末制成CaSO4悬浊液,然后按如下工艺流程进行产生: 
①操作1与操作2的顺序能否调换?______(填能与否),理由是______。
②常温下,CaCO3和CaSO4的溶解度分别为1.5×10-3g和2.1×10-1g,请解析CaSO4向CaCO3转化的原因。________________。
③ 从绿色化学角度考虑,该工艺流程应增加一个操作,这个操作是________________。
参考答案:(1)①NH4++OH- NH3
NH3 +H2O; 稀硫酸
+H2O; 稀硫酸
②使NH4+完全反应,并使NH3从溶液中溢出
③产生的氨气中带有水蒸汽,A、B间缺少一个干燥装置
④烧瓶和导管中有氨气残留,不能完全被稀硫酸吸收
⑤不是
(2)①否;氨气在水中的溶解度大,产量高
②由于CaCO3溶解度小,Ca2+更易与CO32-结合生成沉淀,促使CaSO4溶解
③用生石灰制备CaSO4
本题解析:
本题难度:一般
2、实验题 为证明有关物质的性质,某学生设计了下图所示装置,当打开活塞C,使液体A与隔板H上的固体B相遇时,即有气体产生,并发现D中蜡烛(含碳、氢的化合物)慢慢熄灭,关闭C打开E时,则看到G中蜡烛燃烧得更亮。请写出这名学生有关仪器中盛放的常用物质:A_____________B_____________F__________,用化学方程式表示上述实验中发生的反应(至少写两个): __________________________;__________________________. 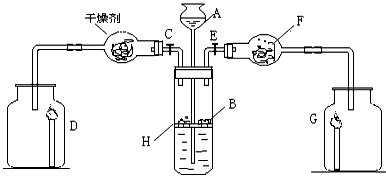
参考答案:A:稀盐酸;B:碳酸钙;F:Na2O2;CaCO3+2HCl=H2O+CO2↑+CaCl2;2Na2O2+2CO2==2Na2CO3+O2
本题解析:
本题难度:一般
3、简答题 (1)写出下列反应的离子方程式:
①硫代硫酸钠(Na2S2O3与稀H2SO4溶液作用时产生无色有刺激性气体溶液变得浑浊:______.
②氯化铁与硫氰化钾起反应,生成红色的溶液:______.
(2)高二化学第一章《硝酸》一节中有浓硝酸、稀硝酸分别跟铜片反应的实验,装置图如下所示.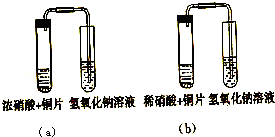
①实验a中试管上部会看到的现象是______,由此证明生成的气体是______.
根据______现象可判断铜被氧化为______,综合起来可得出铜与浓硝酸反应的离子方程式______.
②实验b中试管上部起先可看到______,后来可看到______.由此证明生成的气体是______.写出化学反应方程式______.
③两实验中将导管通入NaOH溶液的中是为了______.
④除了气体颜色、溶液颜色方面的差异外.两实验中还有哪些实验现象有明显差异?写出一条:______,由此你能得出什么结论:______.
参考答案:(1)①Na2S2O3与稀H2SO4溶液作用时产生无色有刺激性气体溶液变得浑浊,反应的离子方程式为:S2O32-+2H+═S↓+SO2↑+H2O,
故答案为:S2O32-+2H+═S↓+SO2↑+H2O;
②三价铁离子和硫氰酸根留住结合生成血红色溶液,反应的离子方程式为Fe3++3SCN-═Fe(SCN)3,
故答案为:Fe3++3SCN-═Fe(SCN)3 ;
(2)①装置图分析,浓硝酸和铜反应生成蓝色溶液硝酸铜、红棕色气体二氧化氮和水,实验a中试管上部会看到的现象是红棕色气体二氧化氮生成,生成的溶液呈蓝色证明是铜被氧化为铜离子,反应的离子方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,
故答案为:红棕色;NO2;生成蓝色溶液;Cu2+;Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
②b是稀硝酸和铜反应生成蓝色溶液硝酸铜,无色气体一氧化氮和水,一氧化氮气体遇到空气中的氧气会发生反应生成红棕色气体二氧化氮,验b中试管上部起先可看到红棕色而银行的气体,空气中的氧气反应完,后来可看到无色气体一氧化氮生成,反应的化学方程式为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O;
故答案为:红棕色气体;无色气体;NO;3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O;
③氮氧化物都是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收;
故答案为:除去氮的氧化物,防止污染空气;
④实验中浓硝酸反应速率大于稀硝酸与铜的反应,证明浓硝酸氧化性大雨稀硝酸,
故答案为:浓硝酸比稀硝酸反应速率快;浓硝酸氧化性比稀硝酸强.
本题解析:
本题难度:一般
4、选择题 根据下列实验现象,所得结论不正确的是( )
| 实验 | 装置 | 实验现象 | 结论 A 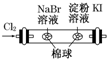 左边棉球变为橙色,右边棉球变为蓝色 氧化性:Cl2>Br2>I2 B 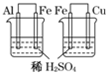 左边烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 活动性:Al>Fe>Cu C 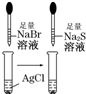 白色固体先变为淡黄色,后变为黑色(Ag2S) 溶解性:AgCl>AgBr>Ag2S D 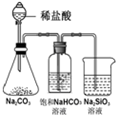 锥形瓶中有气体产生,烧杯中液体变浑浊 酸性:HCl>H2CO3>H2SiO3 |
参考答案:A、氯气具有氧化性,能将溴离子氧化为溴单质,溴单质为橙色,同时次氯酸的漂白性将橙色漂白,氯气能将碘离子氧化为碘单质,碘单质遇到淀粉显示蓝色,同时次氯酸的漂白性将橙色漂白,所以氧化性是Cl2>Br2,Cl2>I2,现象是:左边棉花先变橙色再变无色,右边棉花先变蓝色后变无色,故A错误;
B、两个烧杯形成原电池的工作原理,左边烧杯中,金属铝是负极,右边烧杯中金属铁是负极,在原电池的正极上会产生氢气,负极活泼性强于正极,故B正确;
C、氯化银的溶解能力大于溴化银,溴化银的溶解能力大于碘化银,根据现象结合沉淀会向着更难溶的方向转化,所以溶解性:AgCl>AgBr>Ag2S,故C正确;
D、锥形瓶中有气体二氧化碳产生,烧杯中液体有浑浊硅酸产生,现说明盐酸酸性强于碳酸,碳酸酸性强于硅酸,故D正确.
故选A.
本题解析:
本题难度:简单
5、实验题 (8分)欲配制100mL 0.2mol/L的NaOH溶液,回答下列问题:
(1) (2分)根据计算,所需的NaOH的质量为?,NaOH固体应放在?中称量。(2) (3分)以下是实验操作步 骤,请排出正确的操作顺序:
骤,请排出正确的操作顺序:
①称取所需质量的NaOH
②将溶液转移到容量瓶内
③用蒸馏水洗涤烧杯2~3次,将洗涤液全部移入容量瓶中,摇匀
④改用胶头滴管,小心滴入蒸馏水至刻度
⑤仔细地把蒸馏水注入容量瓶中,直到液面接近刻度线1cm~2cm处
⑥塞上瓶塞。反复摇匀
⑦将称取的NaOH置于烧杯内,加适量蒸馏水,搅拌溶解后冷却
正确的操作顺序是:??
(3) (3分)下列操作会使所配溶液浓度偏低的是?(填选项代号)
A.NaOH放在纸上称量,且出现潮解现象
B.配制前容量瓶内已有少量蒸馏水
C.定容时仰视
D.NaOH溶液未经冷却就转移到容量瓶中去
E.转移溶液时部分溶液溅出容量瓶外
参考答案:(1)(2分)0.8g?,小烧杯。(2)(3分)①⑦②③⑤④⑥(3) (3分) ACE
本题解析:略
本题难度:一般