时间:2017-03-05 16:04:49
1、填空题 (7分)
(1)在25℃条件下将pH=3的醋酸稀释100倍后溶液的pH为?
A.5
B.1
C.1~3之间
D.3~5之间
(2)常温下,pH=3的盐酸和pH=11的氨水等体积混合后,混合溶液中
c(Cl-)?c(NH4+)(填“>”、“=”或“<”)。
(3)常温下,已知某CH3COONa溶液中的c(Na+)=c(CH3COO一),则该溶液的pH?7(填“>”、“=”或“<”)。
(4)如果将NaOH和NH4Cl溶液等浓度、等体积混合,则混合溶液中各离子浓度由大到小的顺序为:c(? )?c(? )?c(? )?c(? )?c(? )
[括号内填离子符号,“?”上填写“>”或“=”]
(5)常温下等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:_____________________________(填序号)
2、选择题 常温时,下列叙述正确的是
A.pH=9的NH4Cl与NH3?H2O混合溶液中c(Cl-)>c )
B.pH=2.5的可乐中c(H+) 是pH=3.5的柠檬水中c(H+)的10倍
C.AgCl在0.1mol /L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同
D.1 mL 1mol /L Na2CO3溶液加水稀释至100mL, pH和Kw均减小
3、填空题 (8分)在6份0.01 mol·L-1氨水中分别加入下列各物质:
A.浓氨水
B.纯水
C.少量K2CO3固体
D.少量浓H2SO4
E.少量NaOH固体? F.少量Al2(SO4)3固体
(1)能使c(OH-)减小、c(NH4+)增大的是?;
(2)能使(OH-)增大、c(NH4+)减小的是?;
(3)能使c(OH-)和c(NH4+)都增大的是?;
(4)能使c(OH-)和c(NH4+)都减小的是?。
4、选择题 下列说法正确的是
A.常温下物质的量浓度相等的①(NH4)2CO3 ②(NH4)2SO4③ (NH4)2Fe(SO4)2三种溶液中水的电离程度:③>②>①
B.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)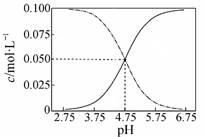
C.向Ca(OH)2溶液中加入过量的NaHCO3溶液:
Ca2++2HCO3-+2OH-→ CO32-+CaCO3↓+2H2O
D.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在如下关系: Kw ·K = Ka
5、填空题 对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。如25℃时有HA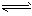 H++A-,则电离平衡常数
H++A-,则电离平衡常数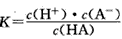 ,K只与温度有关,c为各微粒的平衡浓度。下表是25℃时几种常见弱酸的电离平衡常数。
,K只与温度有关,c为各微粒的平衡浓度。下表是25℃时几种常见弱酸的电离平衡常数。 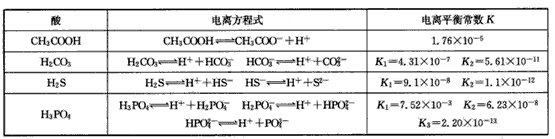
回答下列各题:
(1)K只与温度有关,当温度升高时,K值____(填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱的关系是___
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是 ____,最弱的是____。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在 着数量上的规律,此规律是____,产生此规律的原因是________。
(5)电离平衡常数是用实验的方法测定出来的,现已经测得25℃时cmol/L的CH3COOH的电离度为a(当弱电解质在溶液里达到电离平衡时,溶液中已电离的电解质分子占原来总分子数的百分数叫做该电解质 的电离度)。试表示该温度下醋酸的电离平衡常数K=____。