时间:2017-03-05 16:04:49
1、选择题 下列说法正确的是
A.0.1 mol/L溶液中的(NH4)2SO4溶液中的c(NH4+)<c(SO42-)
B.相同温度下,0.6 mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是2∶1
C.向0.1 mol/L NaNO3溶液中滴加硝酸使溶液pH=5,此时混合液中的c(Na+)<c(NO3-)
D.向醋酸钠溶液中加入适量醋酸,使混合液pH=7,此时混合液中c(Na+)<c(CH3COO-)
参考答案:C
本题解析:A、尽管铵根离子水解,但(NH4)2SO4溶液中的c(NH4+)>c(SO42-),错误;B、对于弱电解质而言,溶液越稀越易电离,所以0.3 mol/L氨水溶液中一水合氨的电离程度大,所以二者的c(OH-)之比小于2:1,错误;C、硝酸钠溶液呈中性,滴加硝酸后溶液呈酸性,所以溶液中c(Na+)<c(NO3-),正确;D、混合溶液呈中性,则c(OH-)= c(H+),根据电荷守恒混合液中c(Na+)=c(CH3COO-),错误,答案选C。
本题难度:一般
2、选择题 物质的量浓度相同的下列溶液中,含粒子种类最多的是
A.CaCl2
B.CH3COONa
C.NH3
D.K2S
参考答案:D
本题解析:CaCl2不水解,溶液中存在的粒子有Ca2+、Cl-、OH-、H+、H2O 5种;CH3COONa发生水解,溶液中存在Na+、CH3COO-、CH3COOH、H+、OH-、H2O 6种粒子;氨水中存在NH3、NH3·H2O、NH4+、OH-、H+、H2O 6种粒子;K2S中S2-发生两步水解,溶液中存在K+、S2-、HS-、H2S、OH-、H+、H2O 7种粒子 ,答案选D。
考点:考查盐类的水解和水的电离。
本题难度:简单
3、选择题 pH=3的盐酸aL分别与下列三种溶液充分反应后溶液呈中性:
①pH=11的氨水bL;②物质的量浓度为1×10-3mol/L的氨水cL;③c(OH-)= 1×10-3mol/L的Ba(OH)2溶液dL
试判断a、b、c、d的大小关系为
[? ]
A.c>a=d>b
B.b>a=d>c
C.c>a>d>b
D.a=b>c>d
参考答案:A
本题解析:
本题难度:一般
4、选择题 用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是
[? ]
参考答案:A
本题解析:
本题难度:一般
5、选择题 pH=13的两种碱溶液M、N各1mL,分别加水稀释到1000mL,其pH与溶液体积(V/mL)的关系如图所示,下列说法正确的是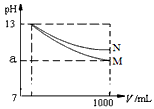
[? ]
A.M、N两种碱溶液的物质的量浓度一定相等
B.稀释后,M溶液的碱性比N溶液强
C.若a=10,则M是强碱,N是弱碱
D.若10<a<13,则M、N都是弱碱
参考答案:CD
本题解析:
本题难度:一般