时间:2017-03-05 15:47:40
1、简答题 KMnO4溶液与浓HCl反应,可生成Cl2:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O若生成71克氯气,需参加反应的氯化氢为多少克?被氧化的氯化氢是多少克?
参考答案:设若生成71克氯气,需参加反应的氯化氢质量为x,则
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
? 584? 355
? x? 71?
则584x=35571,解得x=116.8g,根据方程式可以看出:在所有反应的盐酸中,被氧化的盐酸和参加反应的盐酸的质量之比是5:8,则被氧化的氯化氢的质量为116.8g×58=73g.
答:需参加反应的氯化氢为116.8克,被氧化的氯化氢是73克.
本题解析:
本题难度:一般
2、简答题 利用4FeS2+11O2
参考答案:(1)黄铁矿中含有m(FeS2)=1t×(1-10%)=0.9t,
4FeS2+11O2高温.2Fe2O3+8SO2
4×120g 8×64g
0.9t m
m=0.9t×8×64g4×120g=0.96t,
答:可生产0.96tSO2;
(2)反应中被还原的气体为O2,气体氧化产物为SO2,由方程式可知m(O2):m(SO2)=11×32:8×64=0.6875,
答:被还原的气体物质与气体氧化产物的质量比是0.6875.
本题解析:
本题难度:一般
3、选择题 时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域。测定含I-浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度。主要步骤是
①在中性溶液中,用溴将试样中I-氧化成IO3-,将过量的溴除去
②再加入过量的碘化钾,在酸性条件下,使IO3-完全转化成I2
③将②中生成的碘完全萃取后,用肼将其还原成I-,方程式为H2N-NH2+2I2→4I-+N2↑+4H+
④将生成的I-萃取到水层后用①法处理。
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化。
⑥将⑤反应后的溶液以淀粉作指示剂,用Na2S2O3标准溶液滴定,方程式为:2Na2S2O3+I2→Na2S4O6+2NaI 经过上述放大后,则溶液中I-浓度放大为原溶液中I-浓度的(设放大前后溶液体积相等)
[? ]
A.2倍
B.4倍
C.6倍
D.36倍
参考答案:D
本题解析:
本题难度:一般
4、选择题 在25 ℃时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,在阳极逸出
amol气体,同时有Wg Na2SO4·10H2O析出,若温度不变,此时剩余溶液中溶质的质量分数为
[? ]
A. ×100%
×100%
B.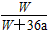 ×100%
×100%
C.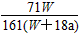 ×100%
×100%
D. ×100%
×100%
参考答案:D
本题解析:
本题难度:一般
5、选择题 将3.2 g Cu跟30.0 mL10.0 mol·L-1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a mol H+离子,则此时溶液中含NO3-离子的物质的量为
[? ]
参考答案:B
本题解析:
本题难度:一般