时间:2017-03-05 14:47:15
1、选择题 下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
| ? | A | B | C | D |
| 强电解质 | Fe | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | H3PO4 | Fe(OH)3 |
| 非电解质 | C12H22O11(蔗糖) | BaSO4 | C2H5OH | H2O |
参考答案:C
本题解析:铁既不是电解质,也不是非电解质,A项错误;NH3是非电解质,BaSO4是强电解质,B项错误;碳酸钙是盐,为强电解质;磷酸是中强酸,是弱电解质,乙醇是非电解质,C项正确;H2O是弱电解质,D项错误。
本题难度:简单
2、填空题 (5分)常温下,将三种一元酸(HX、HY、HZ)分别和NaOH溶液等体积混合,实验数据如下:
| 酸 | c(一元酸) /mol·L–1 | c(NaOH) /mol·L–1 | 混合溶液的pH |
| HX | 0.1 | 0.1 | pH = x |
| HY | 0.1 | 0.1 | pH = 7 |
| HZ | 0.1 | 0.1 | pH = 9 |
参考答案:(5分)(1)HY?
(2)HZ +OH- ="=" H2O + Z-, H2O + Z-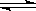 HZ+OH-
HZ+OH-
(3)10x-14?C
本题解析:(1)等物质的量的酸与氢氧化钠混合,溶液的酸碱性取决于酸的强弱,若酸是强酸,则溶液呈中性,若酸是弱酸,则溶液呈碱性,所以上述三种酸中一定属于强酸的是HY;
(2)从HZ与氢氧化钠混合液的pH判断HZ是弱酸,酸性离子方程式时不能拆成离子形式,所以离子方程式为HZ +OH- ="=" H2O + Z-,所得溶液中pH大于7的原因是因为Z-水解使溶液呈碱性,水解的离子方程式为H2O + Z-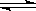 HZ+OH-
HZ+OH-
(3)HX与氢氧化钠溶液反应后的溶液的pH=x,则溶液中的c(H+)=10-xmol/L,溶液中的c(OH-)=10x-14 mol/L,HX若为强酸该溶液为中性溶液,若为弱酸,则该溶液为碱性溶液,所以溶液中的OH-的浓度即是水电离产生的OH-的浓度,c(OH-)=10x-14 mol/L;根据以上分析,x≧7,答案选C。
本题难度:一般
3、填空题 现有一瓶浓度为0.2 mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种。为了确定该酸溶液的组成进行实验:取25.00 mL0.1 mol/L的氢氧化钠溶液,逐滴加入该酸溶液,恰好反应完全时所需该酸溶液体积为12.50 mL。请回答:
(1)该酸不可能是__________;
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为__________,用离子方程式说明溶液呈碱性的原因__________________;
(3)实验中滴定曲线如图, 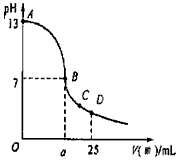
在B点,a_______12.5(填大于、小于或等于)在C点各离子浓度由大到小排序_________________。
参考答案:(1)硫酸
(2)醋酸;CH3COO-+H2O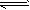 CH3COOH+OH-
CH3COOH+OH-
(3)大于;c(CH3COO-) >c(Na+) > c(H+)>c(OH-)
本题解析:
本题难度:一般
4、选择题 下列图示与对应的叙述一定正确的是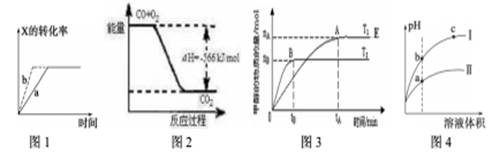
A.图1所示,反应X(g)+2Y(g)3Z(g),b的压强一定比a大
B.图2表示CO生成CO2的反应过程和能量关系
C.图3表示反应CO+2H2CH3OH,其中温度T1>T2,在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,平衡正向移动,氢气浓度增大
D.图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,II表示醋酸,且溶液导电性c>b>a
参考答案:C
本题解析:由于该反应是反应前后气体体积相等的反应,所以无论是增大压强还是使用催化剂,化学平衡都不移动,因此b的压强不一定比a大,A错。图2表示CO与压强发生生成CO2的反应过程,由于反应物的能量比生成物高,所以该反应是放热反应,B对。由图像在温度是T1时首先达到平衡,由于升高温度化学反应速率加快,可知温度T1>T2, 在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,即增大了体系的压强,由于正反应是气体体积减小的反应,所以增大压强,平衡正向移动,但是平衡移动的趋势是微弱的,总的来说氢气浓度是增大,C对。用水稀释pH相同的盐酸和醋酸,由于醋酸是弱酸,在溶液中存在电离平衡,所以产生溶液中离子的浓度变化小,pH变化也小,所以I表示盐酸,II表示醋酸,溶液的pH越大,离子浓度就越小,溶液的导电能力就越弱,所以溶液导电性c<b<a,D错。
本题难度:一般
5、选择题 下列有关说法正确的是
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B.醋酸钠溶液中滴加酚酞显红色,证明醋酸为弱电解质
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
D.某温度下,纯水中的c(H+)=1.0×10-6.5mol/L,则该温度下pH=1的盐酸中水电离的c(H+)=1.0×10-12mol/L
参考答案:BD
本题解析:A.CaCO3(s)=CaO(s)+CO2(g)是体系混乱程度增大的反应,在室温下不能自发进行,说明该反应的△H>0,错误;B.醋酸钠是盐,在其溶液中滴加酚酞显红色,证明醋酸钠是强碱弱酸盐,弱酸根离子发生水解反应消耗水电离产生的c(H+),是溶液中c(OH-)> c(H+),所以醋酸为弱电解质,正确;C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)加快;升高温度,根据平衡移动原理,平衡向吸热的方向移动,对该反应来说,平衡逆向移动,所以氢气的平衡转化率减小,错误;D.某温度下,纯水中的c(H+)=1.0×10-6.5mol/L,Kw=1.0×10-13mol2/L2,所以温度高于室温。则该温度下pH=1的盐酸中水电离的c(H+)= c(OH-)=1.0×10-13mol2/L2÷1.0×10-1mol/L=1.0×10-12mol/L,错误。
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)加快;升高温度,根据平衡移动原理,平衡向吸热的方向移动,对该反应来说,平衡逆向移动,所以氢气的平衡转化率减小,错误;D.某温度下,纯水中的c(H+)=1.0×10-6.5mol/L,Kw=1.0×10-13mol2/L2,所以温度高于室温。则该温度下pH=1的盐酸中水电离的c(H+)= c(OH-)=1.0×10-13mol2/L2÷1.0×10-1mol/L=1.0×10-12mol/L,错误。
考点:考查反应的自发性、盐的水解、化学平衡及弱电解质的电离的知识。
本题难度:一般