时间:2017-03-05 14:47:15
1、填空题 某二元弱酸溶液按下式发生一级和二级电离:
H2A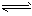 H++HA-
H++HA-
HA-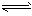 H++A2-。
H++A2-。
已知相同浓度时的电离度,a(H2 A)>a(HA-),设有下列四种溶液:
A.0. 01mol/L的H2A溶液
B.0. 01mol/L的NaHA溶液
C.0. 02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液
D.0. 02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合液
据此填写下列空白(填代号):
(1)c(H+)最大的是____,最小的是____。
(2)c(H2A)最大的是____,最小的是____。
(3)c(A2-)最大的是____,最小的是____。
参考答案:(1)A ;D
(2)C ;D
(3)D ;A
本题解析:
本题难度:一般
2、简答题 室温下,下列关于pH均为9、体积均为10ml的NaOH溶液和CH3COONa溶液比较的说法,正确的是( )
A.两种溶液中的c(Na+)相等
B.分别加热到相同温度时,CH3COONa溶液的pH小
C.分别加水稀释到100mL时,两种溶液的pH依然相等
D.两溶液中由水电离出的c(OH-)之比为
| 10-9 10-5 |
参考答案:A.两溶液因pH均为9,因此c(?CH3COONa)大于c(NaOH),因此CH3COONa溶液中c(Na+)大于NaOH溶液中c(Na+),故A错误;
B.分别加热到相同温度时,NaOH溶液pH变化不大,加热促进CH3COONa水解,其pH增大,故B错误;
C.分别加水稀释到100mL时促进CH3COONa水解,pH减小的小,故C错误;
D.NaOH溶液中由水电离出的c(OH-)为10-9mol/L,CH3COONa溶液中由水电离出的c(OH-)为10-5mol/L,之比为10-910-5,故D正确;
故选D.
本题解析:
本题难度:一般
3、选择题 醋酸在水溶液中存在下列电离平衡:CH3COOH CH3COO-- +H+?下列说法不正确的是:
CH3COO-- +H+?下列说法不正确的是:
A.加入醋酸钠,平衡向左移动,
B.加入碳酸钠,平衡向右移动
C.加水稀释,C(H+)减小
D.加水稀释,溶液中仅有的三种离子浓度都减小。
参考答案:D
本题解析:略
本题难度:一般
4、选择题 常温时,纯水电离的c(H+)=a,PH=1的盐酸中由水电离的c(H+)=b,0.2 mol/L的盐酸与0.1mol/L的氢氧化钠溶液等体积混合后,由水电离的c(H+)=c,则a、b、c的关系正确的是( )
A.a
参考答案:
本题解析:
本题难度:一般
5、选择题
A.自来水
B.0.5 mol·L-1盐酸
C.0.5 mol·L-1 CH3COOH溶液
D.0.5 mol·L-1 KCl溶液
参考答案:B
本题解析:溶液混合后导电能力变化的大小,关键看混合后溶液中自由移动离子的浓度的变化。由于自来水几乎不导电,加入0.05 mol NaOH后,导电性突然增大;醋酸是弱电解质,加入NaOH后,生成强电解质CH3COONa,导电性明显增强;0.5 mol·L-1的KCl中加入0.05 mol NaOH固体后,离子浓度增大,导电能力增强;只有0.5 mol·L-1的盐酸,能与NaOH反应生成强电解质NaCl,不影响导电性。
本题难度:简单