时间:2017-03-05 14:31:09
1、选择题 根据下列热化学方程式
(1)C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
(2)H2(g)+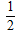 O2(g)=2H2O(l)△H2=-285.8kJ/mol
O2(g)=2H2O(l)△H2=-285.8kJ/mol
(3)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
A.△H=244.1kJ/mol
B.△H=-488.3kJ/mol
C.△H=-996.6kJ/mol
D.△H=996.6kJ/mol
参考答案:B
本题解析:
本题难度:一般
2、填空题 (1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。N-H键的键能是_________________
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)△H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:____________________________
参考答案:(1)391.6 kJ·mol-1
(2)CO(g)+FeO(s)= Fe(s) + CO2(g) △H=-218.00 kJ·mol-1
本题解析:
本题难度:一般
3、简答题 硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答:
(1)氨气催化氧化的化学方程式为______.
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:______.
(3)氨气若在纯氧中燃烧,则发生反应为4NH3+3O2
? |
参考答案:(1)NH3与O2在催化剂、加热条件下发生反应生成NO和H2O:4NH3+5O2?催化剂?.加热4NO+6H2O,故答案为:4NH3+5O2?催化剂?.加热4NO+6H2O;
(2)①CH4(g)+4NO2(g)→4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
? ②CH4(g)+4NO(g)→2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
根据盖斯定律(①+②)×12,得:CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol,故答案为:CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol;
(3)燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,总反应:4NH3+3O2?点燃?.?2N2+6H2O,正极的电极反应:3O2↑+6H2O+12e-=12OH-,负极的电极反应式为:
4NH3+12OH--12e=2N2+12H2O,故答案为:负极;4NH3+12OH--12e=2N2+12H2O;
(4)Cu(NO3)2溶液中铜离子的放电能力大于氢离子的放电能力,所以铜离子先放电;氢氧根离子的放电能力大于硝酸根离子的放电能力,所以氢氧根离子先放电.阳极上失电子,发生氧化反应,所以氢氧根离子在阳极上失电子生成氧气:4OH--4e-=O2+2H2O;阴极上得电子,反应还原反应,所以铜离子的阴极上得电子生成铜:Cu2++2e-=Cu,
故答案为:4OH--4e-=O2+2H2O.
本题解析:
本题难度:一般
4、选择题 在常温常压下,已知:
4Fe(s)+3O2(g)=2Fe2O3(s) △H1
4Al(s)+3O2(g)=2Al2O3(s) △H2
2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) △H3
则△H3与△H1和AH2间的关系正确的是
[? ]
A.△H3=1/2(△H1+△H2)
B.△H3=△H2 -△H1
C.△H3 =2(△H2+△Hl)
D.△H3=1/2(△H2-△H1)
参考答案:D
本题解析:
本题难度:一般
5、选择题 已知石墨、金刚石燃烧的热化学方程式分别为C(石墨、s)+ O2(g)= CO2(g) ΔH2= -393.5kJ/mol,C(金刚石、s)+ O2(g)= CO2(g) ΔH2= -395.4kJ/mol。关于石墨和金刚石的相互转化,下列说法正确的是
[? ]
A.石墨转化成金刚石是自发进行的过程
B.金刚石转化石墨成金刚石是自发进行的过程
C.相同质量时,石墨比金刚石能量低
D.相同质量时,金刚石比石墨能量低
参考答案:BC
本题解析:
本题难度:一般