时间:2017-03-05 14:21:34
1、填空题 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性。某兴趣小组用如图所示装置进行Mg与SO2反应的实验。
(1)选择制取SO2的合适试剂 (填编号)。
①浓HCl ②浓H2SO4
③Na2SO3固体 ④CaSO3固体
(2)上述装置还可优化,优化的方法是 ,实验后装置C中所得溶液离子浓度关系一定正确的是(选填字母)
A.(Na+)= 2c(SO32-)+ c(HSO3-),
B.(Na+)> c(HSO3-)> c(SO32-)> c(H+)> c(OH-),
C.(H2SO3)+ c(H+)= c(SO32-)+ (OH-),
D.(Na+)+ c(H+)=" 2" c(SO32-)+ c(HSO3-)+ c(OH-)
(3)甲同学推测Mg与SO2的反应与CO2相似,则该反应方程式为
乙同学的推测是:2Mg+3SO2 2MgSO3+S;
2MgSO3+S;
丙同学的推测是:3Mg+SO2 2MgO+MgS,
2MgO+MgS,
要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/LNaOH、品红溶液、澄清石灰水、2mol/LCuSO4;仪器和用品自选。请填写下表中的空格:
根据上述实验探究,能证明甲同学推测正确的操作和预期现象是_________________ _
(4)上述实验需要50mL,2mol/L的HCl,配制时应选用 (10 mL ,25 mL ,,50 mL或100 mL)量筒量取36.5%,密度1.19g/mL的浓盐酸的体积。
参考答案:(1)②③(2分)
(2)在A和B之间增加用浓硫酸干燥的装置(2分); D(2分)
(3)2Mg+SO2  2MgO+S;(2分)
2MgO+S;(2分)
②
2mol/L 盐酸至过量(1分);
品红(1分)
固体完全溶解;(1分)
品红溶液褪色(1分);
向反应后所得固体加过量2mol?L?1盐酸,固体未完全溶解且品红溶液不褪色(或反应后固体未完全溶解于盐酸且无色气体产生)(2分)
(4)10ml
本题解析:(1)因SO2的溶解度较大,应选用浓度较大的H2SO4溶液;为了使反应顺利进行须选择Na2SO3固体与硫酸反应(CaSO3固体与硫酸反应生成的硫酸钙微溶于水);
(2)SiO2、CO2都是酸性氧化物,所以镁与玻璃中的二氧化硅能发生反应,镁不能与玻璃管直接接触;又因为镁与钠的性质相似,能与水反应,因此A、B间应加干燥装置;实验后装置C中为Na2SO3溶液,A、根据物料守恒可得:(Na+)= 2c(SO32-)+2 c(HSO3-)+2c(H2SO3),错误;B、Na2SO3分两步水解,以第一步为主,可得:(Na+)> c(OH-)> c(HSO3-)> c(SO32-)> c(H+),错误;C、根据质子守恒可得:(OH-)= c(HSO3-)+ 2(H2SO3)+ c(H+),错误;D、根据电荷守恒可得:(Na+)+ c(H+)=" 2" c(SO32-)+ c(HSO3-)+ c(OH-),正确。
(3)根据Mg与CO2的反应可类比得:2Mg+SO2  2MgO+S;先加入2mol/L 盐酸至过量,可检验产物中是否含有MgS,气体通入品红可检验是否生成了MgSO3,若试管Ⅰ固体完全溶解,说明没有S,则丙同学推测正确;若试管Ⅰ固体未完全溶解且品红溶液褪色,说明产物含有MgSO3,则乙同学推测正确;因为甲同学推测生成MgO和S,所以能证明甲同学推测正确的操作和预期现象是:向反应后所得固体加过量2mol?L?1盐酸,固体未完全溶解且品红溶液不褪色。
2MgO+S;先加入2mol/L 盐酸至过量,可检验产物中是否含有MgS,气体通入品红可检验是否生成了MgSO3,若试管Ⅰ固体完全溶解,说明没有S,则丙同学推测正确;若试管Ⅰ固体未完全溶解且品红溶液褪色,说明产物含有MgSO3,则乙同学推测正确;因为甲同学推测生成MgO和S,所以能证明甲同学推测正确的操作和预期现象是:向反应后所得固体加过量2mol?L?1盐酸,固体未完全溶解且品红溶液不褪色。
(4)设需要浓盐酸的体积为V,可得:0.05L×2mol/L×36.5g/mol=V×1.19g/mL×36.5%,则V=8.4mL,所以选择10mL量筒量取。
考点:本题考查制取气体试剂的选择、反应装置的选用、离子浓度比较、反应方案的分析、浓度的计算。
本题难度:困难
2、填空题 工业上制备 BaC12 的工艺流程图如图所示: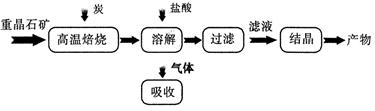
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得: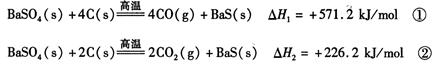
(1)反应C(s) + CO2(g) 2CO(g)的△H = kJ/mol
2CO(g)的△H = kJ/mol
(2)过滤过程中需要使用玻璃棒,玻璃棒的作用是 。
(3)盐酸溶解焙烧的固体后,产生的气体用过量 NaOH 溶液吸收,得到硫化钠溶液。 Na2S 水解的离子方程式为 。
(4)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,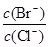 = 。[已知:
= 。[已知:
Ksp(AgBr) = 5.4×10─13 , Ksp(AgCl) = 2.0×10─10]
参考答案:(1)+172.5 (2)引流 (3)S2-+H2O HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O H2S+OH-;(4)2.7×10-3.
H2S+OH-;(4)2.7×10-3.
本题解析:利用盖斯定律将方程式(①-②)/2得C(s) + CO2(g) 2CO(g)的△H ="+172.5" kJ/mol;向
2CO(g)的△H ="+172.5" kJ/mol;向
BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,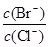 为AgCl与AgBr的溶度积的比值。
为AgCl与AgBr的溶度积的比值。
考点:热化学方程式的计算、盐类的水解、难溶电解质的溶度积。
本题难度:一般
3、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,1 mol氦气含有的电子数目为4NA
B.若CH3COONa溶液中CH3COO-的数目为NA,则Na+的数目大于NA
C.一定条件下,1 mol N2和3 mol H2混合,反应转移的电子数目为6NA
D.标准状况下,11.2 L己烷中含有的化学键数目为9.5NA
参考答案:B
本题解析: A.He是单原子分子,所以常温常压下,1 mol氦气含有的电子数目为2NA,错误;B.CH3COONa是强碱弱酸盐,CH3COO-会发生水解反应而消耗。若CH3COONa溶液中CH3COO-的数目为NA,则Na+的数目大于NA,正确;C.一定条件下,1 mol N2和3 mol H2混合发生反应,由于该反应是可逆反应,反应不可能进行到底,所以转移的电子数目小于6NA,错误;D.标准状况下,己烷的状态是液态,所以不能使用气体摩尔体积来计算,错误。
考点:考查阿伏加德罗常数的有关计算的知识。
本题难度:一般
4、填空题 (8分)按要求填写空白:
(1)写出醋酸钠在水中发生水解反应的离子方程式:____________。
(2)浓度均为0.1mol/L的下列4种物质的水溶液:
①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵
pH由大到小的顺序是_________(填数字序号)。
(3)在①H2O ②HCHO ③Cl2 ④C2H2 ⑤CCl4分子中:
全部以非极性键结合的非极性分子是_________(填数字序号,下同);
全部以极性键相结合,具有V形分子立体构型的是________;
中心原子为sp3杂化的非极性分子是_________;
中心原子为sp2杂化的极性分子是________;
既有极性键又有非极性键的非极性分子是_____________。
参考答案:(1)CH3COO-+H2O CH3COOH+OH-;
CH3COOH+OH-;
(2)③④②① (3)③;①;⑤;②;④
本题解析:(1)醋酸钠是强碱弱酸盐,弱酸根离子水解,消耗水电离产生的H+,破坏了水的电离平衡,最终溶液中OH-的浓度大于H+的浓度,因此溶液显碱性,水解的离子方程式是:CH3COO-+H2O  CH3COOH+OH-;(2)①硫酸是二元强酸,完全电离②醋酸是一元弱酸,部分电离;④氯化铵是强酸弱碱盐,水解使溶液显酸性,由于盐的水解程度是很微弱的,③氢氧化钠是强碱,溶液中的OH-离子的浓度远远大于H+的浓度,所以当它们的浓度相等时,溶液中c(H+)由大到小的顺序是①>②>④>③,溶液的酸性越强,溶液的pH就越小,所以溶液的pH由大到小的顺序是③>④>②>① ; (3)在①H2O中,全部以极性键结合的极性分子;②在HCHO中,全部以极性键结合的极性分子;③Cl2以极性键结合的非极性分子;④C2H2以极性键、非极性键结合的非极性分子;⑤CCl4分子以极性键结合的非极性分子。所以全部以非极性键结合的非极性分子是③Cl2;全部以极性键相结合,具有V形分子立体构型的是①H2O;中心原子为sp3杂化的非极性分子是⑤CCl4分子;中心原子为sp2杂化的极性分子是②;既有极性键又有非极性键的非极性分子是④C2H2。
CH3COOH+OH-;(2)①硫酸是二元强酸,完全电离②醋酸是一元弱酸,部分电离;④氯化铵是强酸弱碱盐,水解使溶液显酸性,由于盐的水解程度是很微弱的,③氢氧化钠是强碱,溶液中的OH-离子的浓度远远大于H+的浓度,所以当它们的浓度相等时,溶液中c(H+)由大到小的顺序是①>②>④>③,溶液的酸性越强,溶液的pH就越小,所以溶液的pH由大到小的顺序是③>④>②>① ; (3)在①H2O中,全部以极性键结合的极性分子;②在HCHO中,全部以极性键结合的极性分子;③Cl2以极性键结合的非极性分子;④C2H2以极性键、非极性键结合的非极性分子;⑤CCl4分子以极性键结合的非极性分子。所以全部以非极性键结合的非极性分子是③Cl2;全部以极性键相结合,具有V形分子立体构型的是①H2O;中心原子为sp3杂化的非极性分子是⑤CCl4分子;中心原子为sp2杂化的极性分子是②;既有极性键又有非极性键的非极性分子是④C2H2。
考点:考查盐的水解、强弱电解质溶液的pH的比较、分子中原子间的化学键、分子的空间结构、原子的杂化等知识。
本题难度:一般
5、选择题 如图表示某物质发生的是( )
参考答案:B
本题解析:由比例模型知,图示表示的是:CH3COO-+H2O CH3COOH+OH-,是CH3COO-发生水解反应的过程,故选B项。
CH3COOH+OH-,是CH3COO-发生水解反应的过程,故选B项。
本题难度:一般