时间:2017-03-05 14:21:34
1、选择题 表示0.1mol/LNaHCO3溶液中有关微粒浓度大小的关系式,正确的是( )
A.(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)[来源:91考试网]
B.(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
C.c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)
D.c(H+)>c(H2CO3)>c(OH-)>c(HCO3-)>c(CO32-)
参考答案:B
本题解析:NaHCO3中,溶液呈碱性,水解大于电离,故有Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);根据电荷守恒B正确。
本题难度:一般
2、填空题 有A、B、C、D四种强电解质,它们在水中电离可产生表中离子(每种物质只含一种阴离子且互不重复)。
| 阳离子 | Na+、Ba2+、NH4+ | 阴离子 | CO32-、Cl-、OH-、SO42- |
 = ;
= ;参考答案:(1)Na2CO3 NH4Cl Ba(OH)2 Na2SO4
(2)10-6
(3)3 : 2
(4)c(OH-)>c(Cl-)=c(Ba2+)>c(NH4+)>c(H+)
本题解析:①A、C溶液的pH均大于7,说明A、C是碱或者是强碱弱酸盐,A、B的溶液中水的电离程度比纯水大,说明A、B均含有弱根离子。A、D焰色反应的火焰均为黄色,说明A、D均含有钠元素。
②C溶液和D溶液相遇时只观察到有白色沉淀产生,白色沉淀可能是碳酸钡或者硫酸钡。B溶液和C溶液相遇时只观察到有刺激性气味的气体产生,刺激性气味的气体是氨气。A溶液和D溶液混合时无明显现象。综合以上信息可知A是Na2CO3,B是NH4Cl C是Ba(OH)2D是Na2SO4
(2)常温,将1 ml pH =12的Ba(OH)2溶液加水稀释至100ml,强碱溶液每稀释10倍,pH下降1.则稀释后pH=10。c(H+)=10-10,c(OH-)=10-4,所得溶液中 =10-6。
=10-6。
(3)常温下,0.15 mol·L-1的Ba(OH)2溶液与0.20 mol·L-1盐酸混合,所得混合液的pH=13。设C溶液的体积为V1与盐酸的体积为V2,则0.15mol/L*2 V1—0.02 mol/L* V2=0.1 mol/L*(V1+ V2)。解得V1/ V2=3 : 2。
(4)将等体积、等物质的量浓度的NH4Cl溶液和Ba(OH)2溶液混合,NH4+和OH-结合生成氨水。导致NH4+和OH-的离子浓度下降。所以反应后溶液中各种离子浓度由大到小的顺序是c(OH-)>c(Cl-)=c(Ba2+)>c(NH4+)>c(H+)。
考点:物质推断,离子浓度大小的比较,pH计算
本题难度:困难
3、选择题 常温下,稀释0.1 mol·L-1Na2CO3溶液,图中的纵坐标可以表示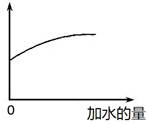
A.CO32-水解的平衡常数
B.溶液的pH
C.溶液中HCO3-的数目
D.溶液中的c(CO32-)
参考答案:C
本题解析:碳酸钠溶于水CO32-水解CO32-+H2O HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O H2CO3+OH-。稀释促进水解。根据图像可知,随着水的加入,纵坐标是增加的。A、水解平衡常数只与温度有关系,因此稀释过程中水解平衡常数不变,A不正确;B、稀释促进水解,溶液中OH-个数增加,但OH-浓度降低,因此溶液的pH减小,B不正确;C、稀释促进水解,HCO3-的浓度减小,但HCO3-个数增加,C正确;、稀释促进水解,c(CO32-)减小,D不正确,答案选C。
H2CO3+OH-。稀释促进水解。根据图像可知,随着水的加入,纵坐标是增加的。A、水解平衡常数只与温度有关系,因此稀释过程中水解平衡常数不变,A不正确;B、稀释促进水解,溶液中OH-个数增加,但OH-浓度降低,因此溶液的pH减小,B不正确;C、稀释促进水解,HCO3-的浓度减小,但HCO3-个数增加,C正确;、稀释促进水解,c(CO32-)减小,D不正确,答案选C。
考点:考查稀释对碳酸钠水解平衡的影响以及离子浓度变化判断
本题难度:一般
4、选择题 在0.1 mol·L-1的NaHS溶液中,下列关系式正确的是
A.c(Na+)=c(HS-)+2c(S2-)+c(H2S)
B.c(HS-)=c(Na+)+c(H+)-c(OH-)-c(S2-)
C.c(OH-)=c(H+)+c(H2S)+c(S2-)
D.c(H+)=c(OH-)+c(S2-)-c(H2S)
参考答案:D
本题解析:试题分析:本题考查学生对电解质溶液部分电荷守恒和物料守恒的理解和掌握。A选项,S2-前面有系数2,不是物料守恒表达式,有H2S分子,又不是电荷守恒关系式,A项错误。B选项,S2-带2个单位负电荷,前面应该乘以2,电荷守恒关系式错误。C选项,质子守恒关系式应为:c(OH-)=c(H+)+2c(H2S)+c(HS-),所以错误。D选项是电荷守恒c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)与物料守恒c(Na+)=c(HS-)+c(S2-)+c(H2S)相减的结果,正确。
考点:离子浓度大小的比较。
本题难度:困难
5、选择题 常温下,下列溶液中的微粒浓度关系正确的是
A.新制氯水中加入固体NaOH:c(Na+) = c(Cl?) + c(ClO?) + c(OH?)
B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3?) > c(CO32?) > c(H2CO3)
C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl?) = c(NH4+) > c(OH?) = c(H+)
D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合: 2c(H+) – 2c(OH?) = c(CH3COO?) – c(CH3COOH)
参考答案:D
本题解析:氯水中加入氢氧化钠固体,溶液中电荷守恒式为c(Na+) +c(H+) = c(Cl?) + c(ClO?) + c(OH?):,A错误;pH = 8.3的NaHCO3溶液呈碱性,说明HCO3?水解强于电离,所以c(H2CO3) > c(CO32?),B错误;pH = 11的氨水与pH = 3的盐酸等体积混合溶液后氨水过量,溶液不呈中性,C错误;0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后电荷守恒:c(Na+) +c(H+)= c(CH3COO?)+ c(OH?)、物料守恒:c(CH3COO?) + c(CH3COOH)="2" c(Na+),c(CH3COOH)+2 c(H+)= c(CH3COO?)+ 2c(OH?),D正确。
考点:微粒浓度比较
点评:灵活运用电荷守恒和物料守恒,注意弱酸酸式根电离与水解以哪种为主。
本题难度:简单