时间:2017-03-05 14:14:37
1、选择题 在相同温度下,100mL 0.1mol·L-1的醋酸与10mL 1mol·L-1的醋酸相比较,下列说法正确的是
A.溶液中H+的物质的量前者大于后者
B.前者的电离程度小于后者
C.发生中和反应时所需NaOH的量前者大于后者
D.溶液中CH3COOH的物质的量前者大于后者
参考答案:A
本题解析:由数据可计算前后溶液所含溶质的物质的量均为0.01mol,所以中和所需NaOH的物质的量相等,同时根据平衡理论,浓度越稀电离程度越大,即发生电离的溶质醋酸物质的量越大,电离出的醋酸根离子的物质的量越大,故选A。
本题难度:一般
2、选择题 已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A.该溶液的c(H+) = 10-4 mol/L
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.将此溶液加水稀释后,电离的HA分子数大于0.1%
参考答案:B
本题解析:A、该溶液中的氢离子浓度为0.1×0.1%= 10-4 mol/L ,故正确,不选A;B、升高温度,平衡正向移动,氢离子浓度增大,pH减小,故选B;C、根据电离平衡常数的计算公式,电离平衡常数=(0.1×0.1%)(0.1×0.1%)÷0.1=1×10-7,故正确,不选C;D、加水稀释后,电离平衡正向移动,电离的分子比原来多,故正确,不选D、
考点:弱电解质的电离。
本题难度:一般
3、选择题 已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 电离平衡常数 1.8×10-5 4.9×10-10 K1=4.3×10-7 K2=5.6×10-11 |
参考答案:A、根据电离平衡常数可知酸性强弱顺序为:CH3COOH>HCN>HCO3-,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大,物质的量浓度的各溶液pH关系为:
pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故A错误;
B、冰醋酸属于弱电解质,加水促进电离,冰醋酸中逐滴加水,溶液的导电性先增大后减小,pH先减小后增大,醋酸的电离程度逐渐增大,故B错误;
C、Na2CO3和NaHCO3等物质的量混合溶液中,存在的阳离子有Na+、H+,阴离子有OH-、HCO3-、CO32-,根据溶液电中性,
存在C(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故C正确;
D、如c(Na+)>c(CN-),根据溶液电中性可知c(H+)<c(OH-),溶液呈碱性,a<b或a═b都符合,故D错误;
故选C.
本题解析:
本题难度:一般
4、填空题 (11分)
(I)在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气;则
(1) 烧杯中放入锌的质量大(填“甲”或“乙”);
(2) 烧杯中的酸过量(填“甲”或“乙”);
(3)反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+) (填“大”或“小”)。
(II)物质的量浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和等质量的Zn反应,则下列说法正确的是:
①产生的H2质量一定相同 ②产生H2的质量一定不同
③仅有一份溶液中存在锌,则一定是盐酸 ④等倍数稀释后的反应速率A>B
⑤产生等量H2所需时间A>B ⑥产生等量H2,盐酸和醋酸一定都有剩余
(III)向体积都为1L,pH都等于2的盐酸和醋酸溶液中投入0.3g Zn,则下图中比较符合客观事实的曲线是 。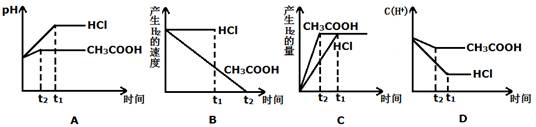
参考答案:(11分)
(Ⅰ)(1)甲 (2)乙 (3)大 (每空2分)
(Ⅱ)③⑤ (2分)
(Ⅲ)ACD (3分)
本题解析:
试题解析:(I)(1)盐酸为强酸,醋酸为弱酸。体积和pH相等,可得n(HCl)<n(CH3COOH)。由于金属跟盐酸、醋酸的反应都是按1:2的比例进行反应的。因此与盐酸反应的锌应过量。
(2)得到相同质量的氢气,则反应掉的酸的物质的量相等,因此乙中的醋酸应剩余。
(3)反应后甲烧杯中的溶质为ZnCl2,乙烧杯中的溶质为(CH3COO)2Zn和CH3COOH;乙烧杯中的溶液为酸性,因此应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)大。
(Ⅱ)物质的量浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和等质量的Zn反应。⑴若锌完全反应,则产生的H2相等;若醋酸完全反应,则产生的H2不相等。因此①②错误。⑵由于加入的锌的质量相等,而溶液中n(HCl)<n(CH3COOH),因此若有一份溶液中的锌有剩余,则应是盐酸中的锌有剩余,故③正确。⑶等倍稀释后,由于稀释促进了醋酸的水解,醋酸中c(H+)增大,因此反应速率增大,故④错误。⑷由于随着反应的进行,盐酸中c(H+)不断减小,而对于醋酸溶液中,c(H+)几乎保持不变,因此产生等量的H2所需的时间A>B,故⑤正确。⑸若产生等量的H2,可以是两种酸都有剩余,也可以是醋酸有剩余,故⑥错误。综上,说法正确的有③⑤。
(Ⅲ) 向体积都为1L,pH都等于2的盐酸和醋酸溶液中投入0.3g Zn,反应后溶液的溶质分别为“ZnCl2和ZnCl2、CH3COOH”,因此A正确。对于选项B、对于产生H2的速率,应是与盐酸反应的会越来越慢;与醋酸反应的,其反应速率基本保持不变,故B错误。选项C、锌的质量相等,其完全反应,因此产生H2的质量想的,再结合对选项B的分析,可知,C图像表示的正确。选项D、随着反应的进行,盐酸中c(H+)不断减小,但醋酸会不断电离出H+,因此其浓度减小的较慢,因此选项D说法正确。综上,答案选ACD。
考点:电解质溶液;弱酸的电离
点评:本题考查电解质溶液的相关知识,是高考的常见考题,掌握弱酸的电离是解题的关键。对于此类题型,应加强训练总结,以求达到举一反三的效果。
本题难度:一般
5、选择题 依据右图分析,下列叙述不正确的是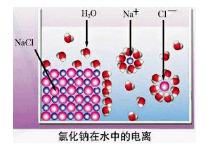
A.氯化钠是由钠离子和氯离子构成的
B.氯化钠的电离方程式为:NaCl =Na+ + Cl—
C.氯化钠的电离过程需要通电才能完成
D.氯化钠在水中形成能自由移动的水合钠离子和水合氯离子
参考答案:C
本题解析:氯化钠是离子化合物,是由离子构成的,A正确;氯化钠是完全电离的,所以选项B正确;电离不需要通电,是在水分子的作用下发生的电离,形成能自由移动的水合钠离子和水合氯离子,C不正确,D正确,答案选C。
点评:该题是高考中的常见题型和考点,属于基础性试题的考查,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:简单