时间:2017-03-05 14:14:37
1、填空题 (1)某温度(t℃)时,水的离子积为Kw=1×10-13,则该温度 25℃(填“>”“=”或“<”),在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,则该溶液的pH可能为 ? 或?。
若温度为25℃时,体积为Va、pH=a的H2SO4溶液与体积为Vb、pH=b的NaOH溶液混合,恰好中和.已知Va>Vb,且a=0.5 b,则a的取值范围 。
(3)若将此温度(t℃)下,pH=11的苛性钠溶液m L与pH=1的稀硫酸溶液nL混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比,并比较溶液中各离子的浓度大小。
①若所得混合液为中性,则m∶n= ;此溶液中各种离子的浓度由大到小排列顺序是 。
②若所得混合液的pH=2,则m∶n= ;此溶液中各种离子的浓度由大到小排列顺序是 。
参考答案:
(1)> 10? 3(每空1分)? (2) 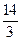 <a<7(2分)
<a<7(2分)
(3) ①10∶1(2分) c(Na+)>c(SO)>c(H+)=c(OH-) (全对得2分)
②9∶2(2分) c(H+)>c(SO)>c(Na+)>c(OH-) (全对得2分)
本题解析:
略
本题难度:简单
2、选择题 已知25 ℃时有关弱酸的电离平衡常数如下表:
| 弱酸化学式 | HF | CH3COOH | HClO | H2CO3 |
| 电离常数 | 6.8×10-4 | 1.7×10-5 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
参考答案:B
本题解析:A、电离平衡常数越大,说明酸越强,所以氢氟酸的酸性大于次氯酸,所以不选A;B、酸越弱,对应的强碱盐水解程度越大,碱性越强,因为4.7×10-8<4.3×10-7,所以前者的pH较大,选B;C、因为4.7×10-8>5.6×10-11,说明次氯酸酸性强些,次氯酸能和碳酸钠反应生成次氯酸钠和碳酸氢钠,所以不选C;D、中和等体积、等pH的HF和CH3COOH溶液,由于电离程度不同,所以溶液的浓度不等,所以消耗的氢氧化钠的量不等,所以不选D。
考点:,电离平衡常数,弱电解质的电离的应用。
本题难度:困难
3、选择题 室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中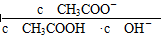 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
参考答案:B
本题解析:本题考查弱电解质的电离平衡,意在考查考生对电离平衡的理解和应用能力。醋酸溶液加水稀释后,CH3COOH的电离程度增大,n(H+)、n(CH3COO-)增大,A项错误;根据CH3COOH的电离平衡常数Ka=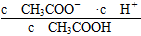 =
= ,则
,则 =
= ,由于温度不变,Ka、KW均不变,因此
,由于温度不变,Ka、KW均不变,因此 不变,B项正确;醋酸加水稀释,电离程度增大,n(H+)增大,但c(H+)减小,C项错误;再加入10 mL pH=11的NaOH溶液,反应后得到CH3COOH和CH3COONa的混合溶液,溶液显酸性,pH<7,D项错误。
不变,B项正确;醋酸加水稀释,电离程度增大,n(H+)增大,但c(H+)减小,C项错误;再加入10 mL pH=11的NaOH溶液,反应后得到CH3COOH和CH3COONa的混合溶液,溶液显酸性,pH<7,D项错误。
本题难度:一般
4、选择题 25℃时,0.1mol/L稀醋酸加水稀释,如图中的纵坐标y可以是( )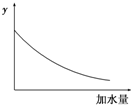
A.溶液的pH
B.醋酸的电离平衡常数
C.溶液的导电能力
D.醋酸的电离程度
参考答案:A.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子浓度逐渐减少,溶液的pH逐渐增大,但始终小于7,故A错误;
B.温度不变,醋酸的电离平衡常数不变,故B错误;
C.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子、醋酸根离子浓度逐渐减少,溶液的导电能力逐渐减小,故C正确;
D.加水稀释促进醋酸电离,则醋酸的电离程度增大,故D错误;
故选C.
本题解析:
本题难度:一般
5、选择题 将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是
[? ]

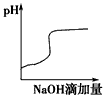
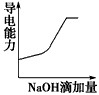
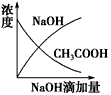
参考答案:D
本题解析:
本题难度:一般