时间:2017-03-05 14:05:06
1、选择题 右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,合这一情况的是 
| | a极板 | b极板 | x电极 | Z溶液 |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
2、选择题 电解NO制备 NH4NO3的工作原理如图所示,X、Y皆Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A。
下列说法正确的是
A.物质A为NH3
B.X电极为电解池阳极
C.Y电极上发生了还原反应
D.Y电极反应式为NO-3e-+4OH-==NO+2H2O
3、填空题 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5 00%的NaOH 溶液、足量的CuSO4溶液和l00g10. 00%的K2SO4溶液,电极均为石墨电极。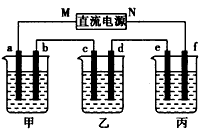
接通电源,经过一段时间后,测得丙中K2SO4浓度为10. 47%,乙中c电极质量增加。据此回答问题:
(1)①电源的N端为_______极;
②电极b上发生的电极反应为______________;
③列式计算电极b上生成的气体在标准状况下的体积:___________________;
④电极c的质量变化是______________g;
(2)电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液_________________________;
乙溶液_________________________;
丙溶液__________________________;
(3)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? ___________________________________________________?。
4、选择题 在下图装置中,若通电一段时间后乙装置左侧电极质量增加,下列说法错误的是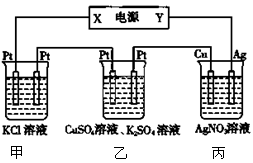
A.当甲装置中共产生标准状况下4.48 L气体时,Cu电极上质量增加43.2g
B.电解过程中装置丙的pH无变化
C.丙中硝酸银溶液的浓度不变
D.乙中左侧电极反应式:Cu2++2e-=Cu
5、计算题 在20 ℃时,用石墨电极电解饱和硫酸铜溶液(阳极放出氧气),如有0.20 mol e-发生转移,试回答以下问题:
(1)在阴极发生什么反应?写出电极反应式,阴极得到铜的质量是多少?
(2)在阳极发生什么反应?写出电极反应式,阳极得到氧气的体积(标准状况)是多少?
(3)电解质溶液的pH发生了什么变化,为什么?
(4)如用铜片代替石墨作阳极,阳极发生什么反应?产物是什么?电解液的pH将如何变化?