时间:2017-03-05 14:03:09
1、选择题 25℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是
A.a=b
B.a>b
C.c (A-)= c(Na+)
D.c (A-)< c(Na+)
参考答案:C
本题解析::若HA为强酸,a=b;若HA为弱酸,则a>b,但无论HA是强酸还是弱酸,均有电荷守恒:
c(Na+)+ c(H+)=c(A-)+ c(OH—),pH=7,c(H+)= c(OH—),所以c(A-) = c(Na+)。
考点:离子浓度比较
点评:本题可直接根据电荷守恒解答。
本题难度:一般
2、简答题 (1)①写出Na2SO4的电离方程式______.
②氧化铝和氢氧化钠溶液反应的离子反应方程式______.
③OH-+H+═H2O改写为化学方程式______.
(2)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用
①Na2CO3、②NaOH、③BaCl2、④HCl,加入的先后顺序可以是______.
(3)下列实验操作中不正确的是______(多选).
A.用分液的方法分离水和汽油的混合物
B.用过滤的方法分离饱和食盐水与沙子的混合物.
C.蒸馏时,应使温度计水银球插入液面以下
D.蒸发结晶时应将溶液蒸干后再停止加热
E.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出.
参考答案:(1)①硫酸钠为强电解质,完全电离,生成钠离子和硫酸根离子,电离方程式为Na2SO4=2Na++SO42-,
故答案为:Na2SO4=2Na++SO42-;
②反应生成偏铝酸根离子和水,离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
③强酸与强碱反应生成可溶性盐和水的离子反应均为OH-+H+═H2O,如H2SO4+2NaOH=2H2O+Na2SO4,故答案为:H2SO4+2NaOH=2H2O+Na2SO4;
(2)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,先镁离子或硫酸根离子,再除去钙离子,最后加盐酸,所以试剂的顺序为②③①④或③②①④,
故答案为:②③①④或③②①④;
(3)A.汽油和水不互溶,分层,所以可利用分液法分离,故A正确;
B.沙子不溶于水,所以用过滤的方法分离饱和食盐水与沙子的混合物,故B正确;
C.蒸馏时,温度计测定馏分的温度,温度计水银球应在蒸馏烧瓶的支管口处,故C错误;
D.蒸发结晶时当有大量固体出现时停止加热,然后利用余热加热即可,故D错误;
E.分液时上层液体从上口倒出,下层液体从下口流出,故E正确;
故答案为:CD.
本题解析:
本题难度:简单
3、选择题 下列有关实验原理、方法和结论都正确的是
A.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中不一定含有SO42-
B.向蛋白质溶液中加入硫酸铜溶液,将得到的沉淀分离出来,再加水可重新溶解。
C.等体积的PH都为3的酸HA和HB分别与足量的Mg反应,HA放出的H2多,说明酸性:HA>HB
D.淀粉在稀硫酸的作用下水解后,加入氢氧化钠使溶液呈碱性,再加入新制Cu(OH)2后加热,若有砖红色沉淀生成,则淀粉已经完全水解。
参考答案:A
本题解析:A正确,因为沉淀也可能是氯化银。硫酸铜属于重金属盐,能使蛋白质变性,而不是盐析,B不正确。C只HA放出的氢气多,说明HA的浓度大,所以在pH相等的条件下,HA的电离程度小于HB的,C不正确。D不正确,只能说明淀粉已经水解,要证明完全水解,还需要单质碘检验,所以答案选A。
本题难度:一般
4、选择题 常温时,下列说法正确的是
①水中加入少量盐酸,由水电离出的c(H+)<10-7mol/L
②水中加入少量NaOH,由水电离出的c(OH-)>10-7mol/L
③水中加入少量NaCl,由水电离出的c(H+)=10-7mol/L
④水中加入少量Na2CO3,由水电离出的c(OH-)>10-7mol/L
A.①②④
B.①②③
C.②③④
D.①③④
参考答案:D
本题解析:
本题难度:困难
5、填空题 稀氨水中存在下列平衡:NH3+H2O NH3·H2O
NH3·H2O NH4++OH-
NH4++OH-
已知,25℃时溶液中存在下列关系:K=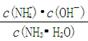 =1.8×10-5
=1.8×10-5
(1)向稀氨水中通入氨气时,平衡向 移动(用“右”、“左”填空,下同),向稀氨水中加入氢氧化钠时,平衡向 移动。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,所得溶液pH 7(填“>”、“<”或“=”),用离子方程式表示其原因: ;若向氨水中加入少量(NH4)2SO4固体,此时溶液中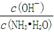 (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。
(3)25℃时,若氨水的起始浓度为0.5 mol/L,平衡时溶液中c(OH-)=__________________,pH=______;向氨水中加入稀硫酸至溶液的pH=7时,c(NH4+)=a mol·L-1,假定HSO4—完全电离,则溶液中c(SO42—)= 。
参考答案:(共13分)
(1)右 (1分) 左 (1分)
(2)< (1分) NH4++H2O NH3·H2O+H+(2分) 减小(2分)
NH3·H2O+H+(2分) 减小(2分)
(3)3×10-3 mol/L(2分) 11.5 (2分) a/2 mol/L(2分)
本题解析:(1)通入氨气,c(NH4+)增大,c(OH-)增大,平衡向右移动。加入氯化铵固体,铵根离子浓度增大,平衡向左移动。
(2)氯化铵是强酸弱碱盐,水解呈酸性,pH<7,离子方程式为NH4++H2O NH3·H2O+H+。向氨水中加入少量(NH4)2SO4固体,水解平衡正向移动,故
NH3·H2O+H+。向氨水中加入少量(NH4)2SO4固体,水解平衡正向移动,故 减小。
减小。
(3)K=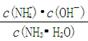 =1.8×10-5。c(OH-)=)3×10-3 mol/L。pH=11.5。向氨水中加入稀硫酸至溶液的pH=7时,c(NH4+)=a mol·L-1,假定HSO4—完全电离,则溶液中c(SO42—)=a/2 mol/L。
=1.8×10-5。c(OH-)=)3×10-3 mol/L。pH=11.5。向氨水中加入稀硫酸至溶液的pH=7时,c(NH4+)=a mol·L-1,假定HSO4—完全电离,则溶液中c(SO42—)=a/2 mol/L。
考点:弱电解质在水溶液中的电离平衡
点评:本题考查了电离平衡的移动,根据勒夏特列原理进行分析解答即可,难度不大。
本题难度:一般