时间:2017-03-05 14:03:09
1、选择题 下列电离方程式书写正确的是( )
A.CaCl2═Ca2++2Cl-
B.K2CO3═K2++CO32-
C.Ba(OH)2═Ba2++(OH)2-
D.FeCl3═Fe2++3Cl-
2、选择题 已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入
NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中不正确的是
[? ]
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
3、选择题 下列溶液一定显酸性的是( )
A.含H+的溶液
B.c(H+)>c(OH-)的溶液
C.使酚酞显无色的溶液
D.pH<7的溶液
4、选择题 下列说法不正确的是
A.0.2 mol·L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32- )
B.将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,盐酸需加的水量多
C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-)
D.pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7
5、实验题 (10分)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并____________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。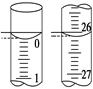
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |