时间:2017-03-05 13:52:37
1、选择题 10mL pH = 10的KOH溶液中,加入pH = 4的一元酸HA溶液至溶液的pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
[? ]
参考答案:AD
本题解析:
本题难度:一般
2、填空题 (1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。100℃时1?mol·L﹣1?的NaOH溶液中,由水电离出的c(H+)=_______mol/L, Kw(25℃)______Kw(100℃)(填“>”、“<”或“=”之一)。
(2)25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是__________(填“促进”“抑制”或“不影响”之一)。 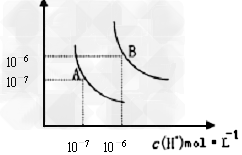
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的pH由大到小的顺序为_____________________。
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则 c(Na+)_______?c(CH3COO-)(填“>”、“<”或“=”之一)。
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为___________________?。
参考答案:(1)1×10-12;<
(2)促进
(3)①Na2CO3溶液的pH>NaCN溶液的pH>CH3COONa溶液的pH;②>;③NaCN+H2O+CO2=HCN+NaHCO3
本题解析:
本题难度:一般
3、选择题 下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.0.1mol?L-1的(CH3COO)2Ba溶液中:c(Ba2+)+c(H+)═2c(CH3COO-)+c(OH-)
B.常温下,向醋酸钠溶液中滴加稀盐酸至中性的混合液中:c(Cl-)>c(Na+)>c(CH3COOH)
C.常温下,pH=6的NaHSO3溶液中:c(SO
参考答案:A.醋酸钡溶液呈电中性,根据电荷守恒得2c(Ba2+)+c(H+)═2c(CH3COO-)+c(OH-),故A错误;
B.溶液呈电中性,所以c(Cl-)+c(CH3COO-)+c(OH-)=c(Na+)+c(H+),溶液呈中性,则c(H+)═c(OH-),则c(Cl-)+c(CH3COO-)=c(Na+),所以c(Na+)>c(Cl-),故B错误;
C.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+2 c(SO3 2- )+(HSO3-),根据物料守恒得c(Na+)=c(SO3 2- )+(HSO3-)+(H2SO3),c(OH-)+c(SO3 2- )=c(H+)+(H2SO3),所以c(SO3 2- )-(H2SO3)=c(H+)-c(OH-)=(10-6-10-8)mol/L=9.9×10-7mol?L-1,故C错误;
D.设氢氧化钾的体积为xL,草酸的体积为yL,钾离子的物质的量=0.1xmol,根据物料守恒得n(H2C2O4)+n(HC2O4-)+n(C2O4 2- )=0.1ymol,则c(K+)+c(H2C2O4)+c(HC2O4-)+n(C2O4 2- )=(0.1x+0.1y)mol(x+y)L=0.1mol?L-1,故D正确;
故选D.
本题解析:
本题难度:简单
4、选择题 某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是
[? ]
A、若溶液中c(A-)= c(Na+),则溶液一定呈中性
B、溶液中不可能存在:c(Na+)> c(A-)> c(OH-)> c(H+)
C、若c(OH-)> c(H+),溶液中不可能存在:c(Na+) > c(OH-) > c(A-) > c(H+)
D、若溶质为NaA、HA,则一定存在:c(A-)> c(Na+)> c(H+)> c(OH-)
参考答案:A
本题解析:
本题难度:一般
5、简答题 (1)配制FeSO4溶液时,常加入少量铁粉,目的是______;常加入少量H2SO4,目的是______
(2)泡沫灭火剂包括Al2(SO4)3溶液(约1mol?L-1)、NaHCO3溶液(约1mol?L-1)及起泡剂.使用时发生的化学反应的离子方程式是______.
(3)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸是黑色固体.AgCl和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体.
①写出白色固体转化黑色固体的化学方程式:______
②白色固体转化成黑色固体的原因是:______
(4)已知下列物质在20℃下的Ksp如下,试回答下列问题:
| 化学式 | ①AgCl | ②AgBr | ③Ag2S | ④Ag2CrO4 Ksp 2.0×10-10 5.4×10-13 2.0×10-48 2.0×10-12 |
| c(Br-) c(Cl-) |
参考答案:(1)FeSO4溶液易被氧化为硫酸铁,加入铁可以防止Fe2+被氧化;Fe2+离子在水溶液中水解使配制的溶液变浑浊,加入少量H2SO4 可以抑制二价铁离子的水解;
故答案为:防止Fe2+被氧化,防止Fe2+水解;
(2)泡沫灭火器中的反应原理是利用铝离子和碳酸氢根离子的双水解生成二氧化碳和氢氧化铝沉淀,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)①AgCl和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体,是发生的沉淀转化,反应的化学方程式为:2AgCl+Na2S═Ag2S+2NaCl;
故答案为:2AgCl+Na2S═Ag2S+2NaCl;
②白色固体转化成黑色固体的原因是:因为Ag2S的溶解度比AgCl的溶解度小,沉淀溶解平衡向离子浓度减小的方向移动;
故答案为:因为Ag2S的溶解度比AgCl的溶解度小,沉淀溶解平衡向离子浓度减小的方向移动;
(4)①、20℃时,上述四种银盐饱和溶液中,Ag+物质的量浓度可以计算得到:①Ksp=C(Ag+)×C(Cl-)=2.0×10-10;C(Ag+)=
本题解析:
本题难度:简单