时间:2017-03-05 13:49:59
1、选择题 用铂电极电解下列溶液,阴极和阳极上的主要产物为分别为H2和O2的是( )
A.稀NaOH溶液
B.HCl溶液
C.CuSO4溶液
D.酸性AgNO3溶液
参考答案:A、电解氢氧化钠的实质是电解水,阴极和阳极上的主要产物为分别为H2和O2,故A正确;
B、电解HCl的实质是电解物质本身,在阴极和阳极上的主要产物为分别为H2和Cl2,故B错误;
C、电解硫酸铜属于“生酸放氧型”,在阴极和阳极上的主要产物为分别为Cu和O2,故C错误;
D、电解硝酸银属于“生酸放氧型”,在阴极和阳极上的主要产物为分别为Ag和O2,故D错误.
故选A.
本题解析:
本题难度:一般
2、选择题 将含有0.4molNaCl和0.5molCu(NO3)2的水溶液用惰性电极电解一段时间后,在
一个电极上得0.3molCu,则在另一个电极上逸出的气体(标准状况下)的体积是(?)
A.4.48L
B.5.6L
C.6.72L
D.11.2L
参考答案:B
本题解析:电极上得0.3molCu,则该电极为正极,得到电子0.6mol,另一极为负极,负极失电子,根据得失电子守恒,负极也将失去0.6mol电子。根据题意,负极发生的反应有2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑,前者先发生,0.4molNaCl失去0.4mol电子,得到0.2mol氯气,则后一反应失去0.2mol电子,将得到0.05mol氧气,因此逸出的气体(标准状况下)的体积是22.4mol/L×(0.2+0.02)mol=5.6L,选项B正确。
点评:本题考查学生对电解池知识的掌握,明确每个电极所发生的反应是解题的关键,难度较大。
本题难度:简单
3、选择题 Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图所示,电解总反应为:2Cu+H2O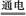 Cu2O+H2↑。下列说法正确的是( )
Cu2O+H2↑。下列说法正确的是( )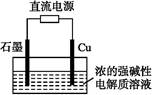
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成
参考答案:A
本题解析:从反应中得知Cu在通电时失电子,在阳极放电,发生氧化反应,另一电极(石墨)作阴极,发生还原反应,2H2O+2e- H2↑+2OH-,相应的Cu
H2↑+2OH-,相应的Cu Cu2O,转移0.1 mol电子生成0.05 mol Cu2O,故B、C、D项错。
Cu2O,转移0.1 mol电子生成0.05 mol Cu2O,故B、C、D项错。
考点:电解原理的应用
本题难度:一般
4、选择题 在铁皮上镀一层锌时,可用如图的装置。以下叙述错误的是
A.电镀前,铁皮可用热碱溶液除油渍,盐酸除铁锈
B.c为铁,d为锌
C.用含Zn2+的盐配成电解质溶液
D.电镀时,发生氧化和还原反应的都是锌元素
参考答案:B
本题解析:A.电镀前,油渍的成份是酯,在碱性条件下易水解,洗净后便于金属附着上去,再用盐酸除铁锈,正确; B.c是阳极,电镀时为镀件铁要做阴极,错误;C.用含Zn2+的盐配成电解质溶液,正确;D.电镀时,发生氧化和还原反应的都是锌元素,正确;
本题难度:一般
5、填空题 人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如下图所示。
(1)电源的负极为 (填“A”或“B”)。
(2)阳极室中发生的反应依次为 、 。
(3)电解结束后,阴极室溶液的pH与电解前相比将 ;若两极共收集到气体13.44 L(标准状况),则除去的尿素为 g(忽略气体的溶解)。
参考答案:(1)B (2)6Cl--6e- 3Cl2↑ CO(NH2)2+3Cl2+H2O
3Cl2↑ CO(NH2)2+3Cl2+H2O N2+CO2+6HCl (3)不变 7.2
N2+CO2+6HCl (3)不变 7.2
本题解析:根据电解池中阴离子在阳极放电和阳离子在阴极放电的规律和本题图中的电极产物H2和Cl2可以判断出A为电源的正极,B为电源的负极,故阳极室中发生的反应依次为:2Cl--2e- Cl2↑,CO(NH2)2+3Cl2+H2O
Cl2↑,CO(NH2)2+3Cl2+H2O N2+CO2+6HCl;
N2+CO2+6HCl;
(3)阴极反应为:6H2O+6e- 6OH-+3H2↑(或6H++6e-
6OH-+3H2↑(或6H++6e- 3H2↑)
3H2↑)
阳极反应为:6Cl--6e- 3Cl2↑
3Cl2↑
CO(NH2)2+3Cl2+H2O N2+CO2+6HCl
N2+CO2+6HCl
根据上述反应可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;由上述反应可以看出,转移6 mol e-时,阴极产生3 mol H2,阳极产生1 mol N2和1 mol CO2,故电解收集到的13.44 L气体中V(N2)=V(CO2)==2.688 L,即n(N2)=n(CO2)=0.12 mol。
根据方程式CO(NH2)2+3Cl2+H2O N2+CO2+6HCl可知生成0.12 mol N2所消耗的CO(NH2)2的物质的量也为0.12 mol,其质量为:m[CO(NH2)2]=0.12 mol×60 g·mol-1=7.2 g。
N2+CO2+6HCl可知生成0.12 mol N2所消耗的CO(NH2)2的物质的量也为0.12 mol,其质量为:m[CO(NH2)2]=0.12 mol×60 g·mol-1=7.2 g。
考点:原电池、电解池、电极反应式
本题难度:一般