时间:2017-03-05 13:49:59
1、填空题 (13分)右图为以惰性电极进行电解: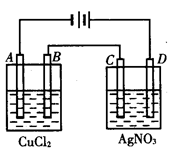 ?
?
(1)写出B、C、D各电极上的电极反应式和总反应方程式:
A:________________________________,
B:________________________________,
总反应方程式:________________________;
C:________________________________,
D:________________________________,
总反应方程式:___________________________;
(2)在A、B、C、D各电极上析出生成物的物质的量比为__________________。
参考答案:(1)Cu2++2e-= Cu? 2Cl--2e-=Cl2↑? CuCl2 Cu+ Cl2↑
Cu+ Cl2↑
4Ag++4e-=4Ag? 4OH--4e-=H2O+O2↑? 4AgNO3+2H2O Ag+O2↑+4HNO3
Ag+O2↑+4HNO3
(2)2:2:4:1
本题解析:(1)D电极和电源的正极相连,所以D电极是阳极,溶液中的OH-放电,电极反应式是4OH--4e-=H2O+O2↑;C是阴极,溶液中的银离子放电,电极反应式是4Ag++4e-=4Ag,总反应式4AgNO3+2H2O Ag+O2↑+4HNO3;B是阳极,溶液中的氯离子放电,电极反应式是2Cl--2e-=Cl2↑;A是阴极,溶液中的铜离子放电,电极反应式是Cu2++2e-= Cu,所以总反应式是CuCl2
Ag+O2↑+4HNO3;B是阳极,溶液中的氯离子放电,电极反应式是2Cl--2e-=Cl2↑;A是阴极,溶液中的铜离子放电,电极反应式是Cu2++2e-= Cu,所以总反应式是CuCl2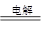 Cu+ Cl2↑。
Cu+ Cl2↑。
(2)根据电子的得失守恒可知,在A、B、C、D各电极上析出生成物的物质的量比为2︰2︰4︰1。
点评:在判断电解产物时,首先判断阳极电极材料。如果是活性电极,则电极本身失去电子。如果是惰性电极,则溶液中的阴离子失去电子。而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序。另外在电解池中的有关计算时,需要借助于电子的得失守恒进行。
本题难度:一般
2、填空题 (9分)(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧热的热化学方程式是____________________________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:__________________;负极的电极反应式:_______________。
(3)下图是一个电解过程示意图。
①锌片上发生的电极反应式是:_____________________________。
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
参考答案:(1)N2H4(l)+O2(g)=N2(g)+2H2O(l) ΔH=-624 kJ·mol-1 (2分)
(2)O2+2H2O+4e-=4OH- (2分) N2H4+4OH--4e-=4H2O+N2↑ (2分)
(3)①Cu2++2e-=Cu (1分) ②112 (2分)
本题解析:(1)1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),则1molN2H4即32g在氧气中完全燃烧生成氮气和H2O,放出19.5kJ×32=624 kJ热量,因此表示N2H4燃烧热的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(l) ΔH=-624 kJ·mol-1。
(2)原电池中负极失去电子,发生氧化反应,正极得到电子发生还原反应,因此该原电池中正极反应式为O2+2H2O+4e-=4OH-,负极是肼失去电子,电极反应式为N2H4+4OH--4e-=4H2O+N2↑。
(3)①锌与电源的负极相连,作阴极,溶液中的铜离子放电,电极反应式为Cu2++2e-=Cu。
②铜片质量变化为128g,即电解128g铜时失去电子的物质的量是 ×2=4mol,因此根据电子得失守恒可知消耗氧气的物质的量是1mol,在标准状况下的体积是22.4L,所以需要空气的体积是22.4L×5=112L。
×2=4mol,因此根据电子得失守恒可知消耗氧气的物质的量是1mol,在标准状况下的体积是22.4L,所以需要空气的体积是22.4L×5=112L。
考点:考查热化学方程式书写以及电化学原理的应用
本题难度:一般
3、填空题 (16分)某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果。
已知:C(s)+O2(g)  CO2(g) △H=-393kJ?mol-1;
CO2(g) △H=-393kJ?mol-1;
2CO (g)+O2(g)  2CO2(g) △H=-566kJ?mol-1;
2CO2(g) △H=-566kJ?mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-484kJ?mol-1
(1)将水蒸气喷到灼热的炭上实现炭的气化(制得CO、H2),该反应的热化学方程式为 。
(2))将一定量CO(g)和H2O (g)分别通入容积为1L的恒容密闭容器中,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |

 2CO+O2,若阳极为溶液中的OH-放电,则阳极的电极反应式为 。
2CO+O2,若阳极为溶液中的OH-放电,则阳极的电极反应式为 。参考答案:(1)(2分)C(s)+H2O(g)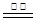 CO(g)+H2(g) △H=+132kJ?mol-1
CO(g)+H2(g) △H=+132kJ?mol-1
(2)①放热(2分) ②0.8mol/(L·min) (2分)
③20%((2分) ④加催化剂(2分) [画曲线见右图] 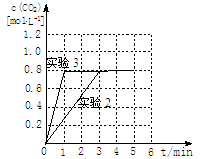 (2分)
(2分)
(3)(2分)4OH--4e-=O2↑+2H2O
(4)(2分)CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3
本题解析:(1)已知:①C(s)+O2(g)  CO2(g) △H=-393kJ?mol-1;②2CO (g)+O2(g)
CO2(g) △H=-393kJ?mol-1;②2CO (g)+O2(g)  2CO2(g) △H=-566kJ?mol-1;③2H2(g)+O2(g)=2H2O(g) △H=-484kJ?mol-1,根据盖斯定律:①—②×1/2—③×1/2得该反应的热化学方程式为C(s)+H2O(g)
2CO2(g) △H=-566kJ?mol-1;③2H2(g)+O2(g)=2H2O(g) △H=-484kJ?mol-1,根据盖斯定律:①—②×1/2—③×1/2得该反应的热化学方程式为C(s)+H2O(g)  CO(g)+H2(g) △H=+132kJ?mol-1;(2)①根据题给反应和等效平衡知识知,温度为500℃时,起始容器中加入2molH2O、4molCO时,达平衡后CO2的物质的量为1.6mol,750℃时达平衡后CO2的物质的量为0.8mol,则升高温度,平衡逆向移动,该反应的正反应为放热反应。②根据题给反应知,v(H2)= v(CO2),实验1中,0~4min时段内,v(H2)=3.2÷(1×4)="0.8" mol/(L·min);③分析题给数据知,实验2达到平衡时CO的转化率=0.8/4×100%=20%;④实验3与实验2相比,化学平衡没有移动,只是缩短了达平衡时间,容器的体积恒定为1L,故改变的条件是加催化剂;图像见答案;(3)电解过程中若阳极为溶液中的OH-放电,则阳极的电极反应式为4OH--4e-=O2↑+2H2O;(4)将CO通入银氨溶液中可析出黑色的金属颗粒银,其反应方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3。
CO(g)+H2(g) △H=+132kJ?mol-1;(2)①根据题给反应和等效平衡知识知,温度为500℃时,起始容器中加入2molH2O、4molCO时,达平衡后CO2的物质的量为1.6mol,750℃时达平衡后CO2的物质的量为0.8mol,则升高温度,平衡逆向移动,该反应的正反应为放热反应。②根据题给反应知,v(H2)= v(CO2),实验1中,0~4min时段内,v(H2)=3.2÷(1×4)="0.8" mol/(L·min);③分析题给数据知,实验2达到平衡时CO的转化率=0.8/4×100%=20%;④实验3与实验2相比,化学平衡没有移动,只是缩短了达平衡时间,容器的体积恒定为1L,故改变的条件是加催化剂;图像见答案;(3)电解过程中若阳极为溶液中的OH-放电,则阳极的电极反应式为4OH--4e-=O2↑+2H2O;(4)将CO通入银氨溶液中可析出黑色的金属颗粒银,其反应方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3。
考点:考查热化学方程式书写、盖斯定律,化学反应速率和化学平衡,电极反应式、化学方程式的书写。
本题难度:困难
4、填空题 (14分)(1)氨的合成是最重要的化工生产之一,工业上合成氨用的H2有多种制取的方法。用天然气跟水蒸气反应:CH4(g)+H2O(g)  CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。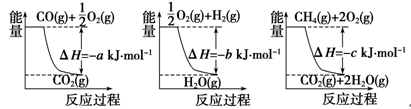
(2)已知通常状况下,每充分燃烧1gCO并恢复到原状态,会释放10KJ的热量。请写出表示CO燃烧热的热化学反应方程式: 。
(3)一种甲烷燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接通入甲烷,同时向一个电极通入空气。此电池的负极电极反应式是________________________________________________。
(4)利用下图装置可以模拟铁的电化学防护。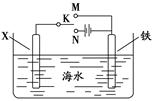
①若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。假设海水中只有NaCl溶质,写出此时总离子反应方程式: 。
②若X为锌,开关K置于M处,该电化学防护法称为 。
写出铁电极处的电极反应式: 。
参考答案:(1)ΔH=(a+3b-c) kJ·mol-1 (2分)
(写成ΔH=+(a+3b-c) kJ·mol-1 或ΔH=-(c-a-3b) kJ·mol-1均正确漏写单位扣1分)
(2)CO(g)+1/2O2(g)=CO2(g) ΔH=-280KJ/mol (2分)
(无状态不得分;CO系数不为1不得分;漏单位扣1分。)
(3)CH4 -8e- + 2H2O = CO2 + 8H+ (2分)
(物质错漏不得分,系数错扣1分)
(4)①N(2分) 2Cl-+2H2O 2OH-+H2↑+Cl2↑ (2分)
2OH-+H2↑+Cl2↑ (2分)
(写成化学方程式不得分;系数、条件和箭头错总扣1分)
②牺牲阳极的阴极保护法 (2分) O2+2H2O+4e—=4OH— (2分)
本题解析:(1)三个反应的热化学方程式为:①CO(g)+1/2O2(g)=CO2(g) ΔH=-aKJ/mol, ②2H2(g)+O2(g)=2H2O(g) ΔH=-bKJ/mol,③CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-cKJ/mol,根据盖斯定律分析,三个反应应该①+3×②-③,所以反应热ΔH=(a+3b-c) kJ·mol-1。(2)1克一氧化碳的物质的量为1/28摩尔,所以每摩尔一氧化碳反应生成二氧化碳反应放出的热量为280KJ所以热化学方程式为:CO(g)+1/2O2(g)=CO2(g) ΔH=-280KJ/mol。(3)甲烷在原电池中左负极,在酸性条件下反应生成二氧化碳和水,电极反应为:CH4 -8e- + 2H2O = CO2 + 8H+。(4)①X为碳棒,减缓铁的腐蚀,需要将铁电解池的阴极,即连接N;电解氯化钠,反应生成氢氧化钠和氢气和氯气,离子方程式为:2Cl-+2H2O 2OH-+H2↑+Cl2↑。②X为锌,开关在M处,则铁做原电池的正极,这种电化学防护法为牺牲阳极的阴极保护法; 铁为原电池的正极,发生吸氧腐蚀,电极反应为:O2+2H2O+4e—=4OH—。
2OH-+H2↑+Cl2↑。②X为锌,开关在M处,则铁做原电池的正极,这种电化学防护法为牺牲阳极的阴极保护法; 铁为原电池的正极,发生吸氧腐蚀,电极反应为:O2+2H2O+4e—=4OH—。
考点:化学反应与能量
本题难度:困难
5、选择题 下图是工业电解饱和食盐水的装置示意图,下列有关说法不正确的是
A.装置中的离子交换膜只能让阳离子通过,不能让阴离子通过
B.装置中出口①处的物质是氢气,出口②处的物质是氯气
C.除去杂质后的氢氧化钠溶液从出口B处导出
D.转移电子0.8 mol时产生氢气8.96 L(标准状态)
参考答案:B
本题解析:电解饱和食盐水时溶液阳极产生的气体是氯气,阴极产生的气体是氢气,所以①处的物质是氯气,出口②处的物质是氢气,B正确;离子交换膜可以让阴阳离子通过,A错误;阴极产生的氢气和氢氧化钠所以氢氧化钠溶液从B处导出,根据电极反应方程式 ,转移0.8moL电子时生成的氢气为0.4moL,体积为
,转移0.8moL电子时生成的氢气为0.4moL,体积为 ,所以答案选B。
,所以答案选B。
本题难度:简单